题目内容
【题目】酸、碱、盐溶解性表是学习化学的重要工具。下表列出了“部分酸、碱、盐在20 ℃时的溶解性”,请利用此表完成以下任务:
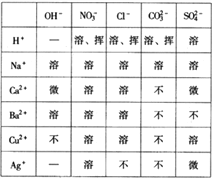
⑴查:Ba(OH)2的溶解性________________。
⑵写化学式:一种酸__________,一种不溶于水的盐___________。
⑶判断:氯化钠溶液与硝酸钙溶液能否发生反应________________,理由是________________。
⑷写化学方程式:氯化钡溶液与表中的一种盐反应______________________。
【答案】 易溶 HCl\HNO3\ H2SO4 CaCO3\BaCO3\BaSO4 不反应 没有沉淀、气体、水生成/不符合复分解反应发生的条件 BaCl2+ Na2SO4=== BaSO4↓+2 NaCl
【解析】(1)由表可知,氢氧化钡的溶解性是易溶;
(2)酸根离子与氢氢离子构成的物质是酸,比如HCl\HNO3\ H2SO4;由金属离子和酸根离子构成的物质是盐,其中CaCO3\BaCO3\BaSO4不溶于水,是沉淀;
(3)氯化钠和硝酸根不能生成气体、沉淀和水,不符合复分解反应的条件,故不能反应;
(4)氯化钡与硫酸钠反应生成硫酸钡和氯化钠,反应方程式为BaCl2+ Na2SO4=== BaSO4↓+2 NaCl

【题目】日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好。下面是对影响碳酸钠溶液碱性的因素展开探究。
用碳酸钠固体和不同温度的水,配置溶质质量分数分别为2%、6%和10%的碳酸钠溶液,立即测量溶液的pH,记录数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
水的温度/℃ | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 60 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
请你分析表中数据回答:
(1)去油污的效果最好的是___________(填实验编号)。
(2)在一定温度范围内,温度对碳酸钠溶液pH的影响是:当碳酸钠溶液的质量分数相同时,_________。
(3)要画出碳酸钠溶液的pH随溶液中溶质质量分数的变化关系曲线,可选择的一组实验是___________(填实验编号),结论是___________。
(4)如果某实验小组想得到更好的去污效果,根据之前的实验规律,可以尝试的实验条件是___________。
A.12%、60℃ B.8%、40℃ C.10%、70℃
(5)该小组配制50g 10% Na2CO3溶液的流程图如下所示:
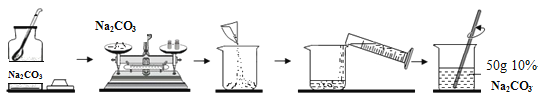
该小组应称量Na2CO3的质量为__________g,若称量Na2CO3固体时指针向右偏转,则应____________________________直到天平平衡.