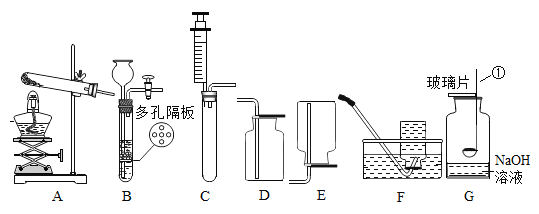
题目内容
【题目】某氯化钾样品中含有少量MgCl2、Na2SO4和CaCl2杂质,某化学兴趣小组欲除去其中的杂质,得到纯净的KCl晶体,设计了如下图所示的实验方案。请回答下列问题:
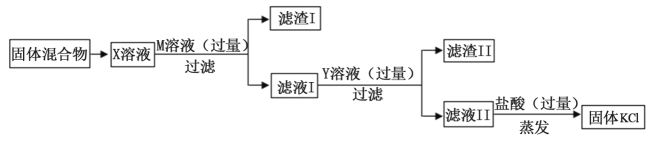
①写出M溶液中溶质的化学式______。
②Y溶液的作用是什么______?
③滤液II中除氯化钾以外,还含有其它溶质成分,如何检验______?(写出实验步骤和现象)
【答案】Ba(OH)2 除尽Ca2+和Ba2+或除尽CaCl2、BaCl2和Ba(OH)2 取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,静置,取上层清液滴加酚酞溶液,溶液变红
【解析】
(1)M溶液为氢氧化钡溶液,溶质的化学式为Ba(OH)2;氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,和硫酸钠反应生成硫酸钡沉淀和氯化钠。
(2)除杂的过程加入的氢氧化钡是过量的,加入Y,需要出去氢氧化钡和氯化钙,所以Y是碳酸钾,碳酸钾和氢氧化钡反应生成碳酸钡沉淀和氢氧化钾,和氯化钙反应生成碳酸钙沉淀和氢氧化钾;
(3)反应后溶液中有氢氧化钾和剩余的碳酸钾以及原有的氯化钾,故滤液II中除氯化钾以外,还含有其它溶质成分,检验的方法为:取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,静置,取上层清液滴加酚酞溶液,溶液变红。

【题目】在宏观、微观和符号之间建立联系是化学学科的特点。甲和乙反应生成丙和丁的化学方程式用下列微观示意图表示:
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观 示意图 |
| ||||
①请写出丙物质的化学式_____;下列属于丁物质的微观示意图的是_____。

②能保持甲化学性质的微粒是_____(填“分子”或“原子”),四种物质中属于氧化物的有_____(填甲、乙、丙、丁)。
③从上述反应重能获得的信息有_____(填一条即可)。
④上述微观示意图表示的化学方程式是:_____。