题目内容
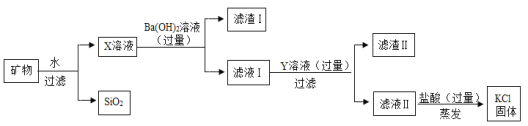
【题目】在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲乙丙丁4种物质的质量分数,得到质量分数分布图分别如下:
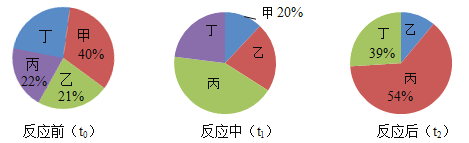
下列说法错误的是( )
A. 该反应中,乙是反应物,丁是生成物
B. t1时刻,甲和乙的质量比为5:7
C. 若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2:1
D. 若反应前物质总质量为100克,如果再增加20g甲,则甲与乙可恰好完全反应
【答案】BC
【解析】
由反应前(t0)可知,丁的质量分数=1-21%-22%-40%=17%。由反应后(t2)可知,乙的质量分数=1-54%-39%=7%,甲的质量分数为0。参加反应的甲、乙、丙、丁的质量比为40%:(21%-7%):(54%-22%):(39%-17%)=20:7:16:11。由图可知,甲、乙质量分数减小,属于反应物,丙、丁质量分数增大,属于生成物。
A、由分析知,该反应中,乙是反应物,丁是生成物,正确,不符合题意;
B、由图可知,t1时刻,甲反应了二分之一,故乙消耗的质量分数为(21%-7%)×![]() =7%,故t1时刻,甲和乙的质量比为20%:(21%-7%)=10:7,错误,符合题意;
=7%,故t1时刻,甲和乙的质量比为20%:(21%-7%)=10:7,错误,符合题意;
C、若为碳还原氧化铜,则 ,160:12≠20:7,质量比不符合;若为一氧化碳还原氧化铜,则
,160:12≠20:7,质量比不符合;若为一氧化碳还原氧化铜,则![]() ,80:28 =20:7,质量比符合要求。但此时甲、乙的化学计量数之比为1:1,错误,符合题意;
,80:28 =20:7,质量比符合要求。但此时甲、乙的化学计量数之比为1:1,错误,符合题意;
D、若反应前物质总质量为100克,则甲的质量为40g,乙的质量为21g,再增加20g甲,则反应前甲、乙质量比为(40g+20g):21g=20:7,所以甲与乙可恰好完全反应,正确,不符合题意。故选BC。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目