题目内容
【题目】(1)用化学符号填空
①食醋中酸_____________;
②2个在溶液中显黄色的离子_______;
(2)亚氯酸钠( NaClO2)是一种重要的含氯消毒剂,主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。
①亚氯酸钠氯元素的化合价为______;
②亚氯酸钠(NaClO2)在酸性溶液中生成HClO2而发生分解,HClO2不稳定,分解的化学方程式:5HClO2=4X↑+HCl+2H2O 。则X的化学式为_________;
(3)在密闭容器内进行的某反应,测得反应前(t0)、反应中(t1)、反应后(t2)不同时刻甲、乙、丙、丁四种物质的质量分数分别如图所示
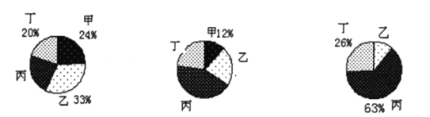
反应前(t0) 反应中(t1) 反应后(t2)
若反应前四种物质的总质量为100g,如果再增加______g甲,则甲与乙可恰好完全反应;
(4)室温下,将m克锌粉和铜粉的混合物加到一定质量的AgNO3和Fe(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和滤液,则下列说法中错误的是_____ (填序号)
a 滤液一定是无色的 b 滤液中一定有Cu2+
c 滤渣的质量一定大于m克 d 滤渣中一定有Ag
(5)已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入等质量等溶质质量分数的稀盐酸,然后在左边的烧杯中放入铁,在右边的烧杯中放入与铁质量相等的锌
①若酸足量,在整个反应过程中,天平指针变化情况是 ___________________;
②若最终天平保持平衡,则两种金属_____ (选填“一定”或“不一定”)都有剩余。
【答案】CH3COOH 2Fe3+ +3 ClO2 12 D 先偏左后偏右 不一定
【解析】
(1)①食醋中酸是醋酸,醋酸可以表示为CH3COOH;
②铁离子在溶液中显黄色的离子,2个铁离子表示为:2Fe3+;
(2)①亚氯酸钠( NaClO2)中,钠元素的化合价为+1,氧元素的化合价为-2,设:亚氯酸钠(NaClO2)中氯元素的化合价为x,根据在化合物中正负化合价代数和为零,则有:(+1)+x+(-2)×2=0, x=+3。
②根据化学方程式:5HClO2=4X↑+HCl+2H2O可知,反应前:5个氢原子、5个氯原子、10个氧原子,反应后5个氢原子、1个氯原子、2个氧原子和4X,根据质量守恒定律,化学反应中原子的种类和数目不变, 4X共有4个氯原子、8个氧原子,故X的化学式为ClO2;
(3)反应后乙的质量分数为1-26%-63%=11%,参加反应的甲、乙的质量比为24%:(33%-11%)=12:11,若反应前甲、乙、丙、丁四种物质的总质量为100克,则反应前甲的质量为24g,乙33g,设:再增加甲的质量为x,则甲与乙可恰好完全反应,(24g+ x):33g=12:11,x=12g,再增加12克甲,则反应前甲、乙质量比为,甲与乙则恰好完全反应;
(4)由于金属的活动性顺序是锌>铁>铜>银,将锌粉和铜粉的混合物加到一定质量的AgNO3和Fe(NO3)2的混合溶液中,锌先与硝酸银反应生成了硝酸锌和银,当硝酸银反应完成后锌与硝酸亚铁反应生成了硝酸锌与铁,若有剩余硝酸银,铜能硝酸银反应生成了硝酸铜和银。反应的质量关系是:
![]()
![]()
![]() 由于锌与硝酸银反应滤渣的质量增加,铜与硝酸银反应滤渣的质量增加,锌与硝酸亚铁反应滤渣的质量减少。若滤渣质量小于mg,说明锌一定与硝酸亚铁发生了反应,铜没有发生反应;若滤渣质量大于mg,锌可能与硝酸亚铁发生了反应。
由于锌与硝酸银反应滤渣的质量增加,铜与硝酸银反应滤渣的质量增加,锌与硝酸亚铁反应滤渣的质量减少。若滤渣质量小于mg,说明锌一定与硝酸亚铁发生了反应,铜没有发生反应;若滤渣质量大于mg,锌可能与硝酸亚铁发生了反应。
A 若滤渣质量小于mg,不能确定溶液中的硝酸亚铁是否完全反应,滤液不一定是无色的,故A错误;
B 由上述反应可知,若锌的质量不足,铜与硝酸银发生了反应,滤液中才有Cu2+,故B错误;
C 由上述分析可知,滤渣的质量可能大于m克,也可能小于m克等,故C错误;
D 由上述分析可知,滤渣中一定有Ag,故D正确。故选D。
(5)①锌比铁活泼,因此锌和稀盐酸反应速率较快,单位时间内产生氢气较多,天平向左偏,如果稀盐酸足量,最终铁和稀盐酸反应生成的氢气多,最终天平向右偏。若酸足量,则天平先偏左后偏右;
②若最终天平保持平衡,说明产生氢气质量相等,可能是锌恰好完全反应,铁过量。两种金属不一定都有剩余。

 阅读快车系列答案
阅读快车系列答案【题目】生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 5.8g | 94.6g | 150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为____ g;
(2)样品中碳的质量分数 ____(计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数____(计算结果保留到0.1%)。