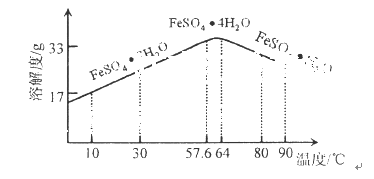
题目内容
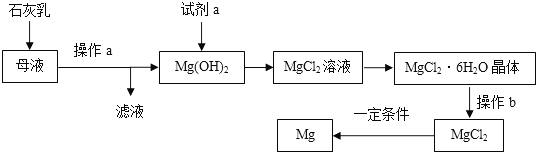
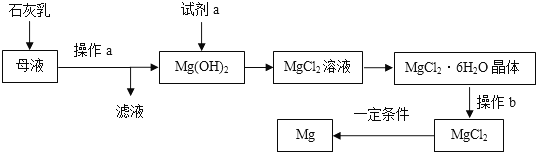
【题目】自来水消毒过程中常发生下列转化:
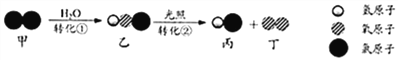
下列说法正确的是 ( )
A. 反应前后分子不可分 B. 转化①是化合反应
C. 转化②中丙和丁的分子个数之比为1︰1 D. 转化①、②中氯元素的化合价都发生变化
【答案】D
【解析】A、由图示可知,一个氯气分子和一个水分子反应生成一个氯化氢分子和一个次氯酸分子。两个次氯酸分子反应生成两个氯化氢分子和一个氧分子。化学方程式为:转化①H2O+Cl2=HCl+HClO;转化②2HClO ![]() 2HCl+O2↑。由微粒的变化可知,应前后分子发生了变化,分子可再分,错误;B、由转化①H2O+Cl2=HCl+HClO可知,生成物是两种,不是化合反应,错误;C、转化②2HClO
2HCl+O2↑。由微粒的变化可知,应前后分子发生了变化,分子可再分,错误;B、由转化①H2O+Cl2=HCl+HClO可知,生成物是两种,不是化合反应,错误;C、转化②2HClO ![]() 2HCl+O2↑中丙和丁的分子个数之比为2:1,错误;D、转化①中氯元素的化合价由0变为+1,②中氯元素的化合价由+1,变为-1,都发生改变,正确。故选D。
2HCl+O2↑中丙和丁的分子个数之比为2:1,错误;D、转化①中氯元素的化合价由0变为+1,②中氯元素的化合价由+1,变为-1,都发生改变,正确。故选D。

练习册系列答案
相关题目
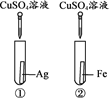
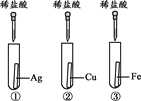
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是___________。