题目内容
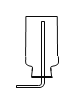
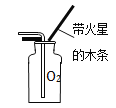
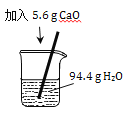
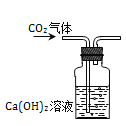
【题目】根据酸的五条化学性质回答下列问题。
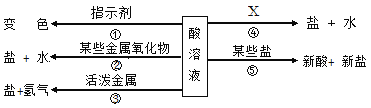
(1)写出符合性质③的一个反应的化学方程式_____;
(2)图中的X代表一类物质,则X为______(填物质类别),请写出符合性质④的一个有硫酸参与反应的化学方程式_______;
(3)酸溶液有相似化学性质的原因是溶液中都含有_____(填离子符号)。
【答案】H2SO4 + Zn = ZnSO4 + H2↑ 碱 2NaOH+H2SO4 = Na2SO4+2H2O H+
【解析】
(1)排在H前面的金属能和酸反应生成氢气,如H2SO4 + Zn = ZnSO4 + H2↑;(2)酸与碱反应能生成盐和水,所以X应是碱,硫酸和氢氧化钠反应生成硫酸钠和水,化学方程式为:2NaOH+H2SO4 = Na2SO4+2H2O;(3)酸溶液有相似化学性质的原因是都含有H+。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】小明想测定Cu-Fe合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀硫酸和相关仪器。
(1)根据现有的条件,你认为只能测出________合金中铜的质量分数。
(2)为了测定该合金的组成,小明称取20g该合金粉末,将80g稀硫酸分两次加入粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | |
连续加入稀硫酸的质量(g) | 40 | 40 |
生成氢气的质量(g) | 0.3 | 0.1 |
从上表数据分析,小明用20g合金粉末总共收集到氢气_________g。
(3)求出该合金中铜的质量分数为_________。(写出具体计算过程)