题目内容
【题目】MgSO4·7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4·7H2O晶体的主要流程如下:
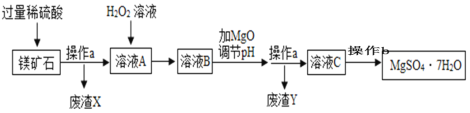
已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作b”的名称是________。该操作中玻璃棒作用____________。
(2)“废渣Y”中含有少量的FeOOH,其中铁元素的化合价是______。
(3)MgCO3溶于稀硫酸的化学方程式为______________,其反应类型为________。
(4)选用MgO调节pH而不选用NaOH的原因是_________。
【答案】蒸发 使液体受热均匀,防止飞溅 +3 ![]() 复分解反应 使用氢氧化钠会引入新的杂质
复分解反应 使用氢氧化钠会引入新的杂质
【解析】
镁矿石(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() ),加热过量的稀硫酸,碳酸镁和稀硫酸反应生成硫酸镁和水和二氧化碳,碳酸亚铁和稀硫酸反应生成硫酸亚铁和水和二氧化碳,
),加热过量的稀硫酸,碳酸镁和稀硫酸反应生成硫酸镁和水和二氧化碳,碳酸亚铁和稀硫酸反应生成硫酸亚铁和水和二氧化碳,![]() 既不溶于水也不溶于稀硫酸,经过操作a过滤,废渣为二氧化硅,溶液A中加入过氧化氢,生成硫酸铁,加入氧化镁调节pH值,使铁离子转化为沉淀,得到硫酸镁溶液,通过蒸发结晶得到
既不溶于水也不溶于稀硫酸,经过操作a过滤,废渣为二氧化硅,溶液A中加入过氧化氢,生成硫酸铁,加入氧化镁调节pH值,使铁离子转化为沉淀,得到硫酸镁溶液,通过蒸发结晶得到![]() 。
。
(1)操作b是硫酸镁溶液通过蒸发结晶得到![]() ,故“操作b”的名称是蒸发。操作中玻璃棒作用使液体受热均匀,防止飞溅。
,故“操作b”的名称是蒸发。操作中玻璃棒作用使液体受热均匀,防止飞溅。
(2)根据化学式化合价代数和为零,“废渣Y”中含有少量的![]() ,设铁元素的化合价为x,则
,设铁元素的化合价为x,则![]() ,故铁元素的化合价是+3价。
,故铁元素的化合价是+3价。
(3)![]() 溶于稀硫酸反应生成硫酸镁和水和二氧化碳,反应的化学方程式为
溶于稀硫酸反应生成硫酸镁和水和二氧化碳,反应的化学方程式为![]() ,其反应类型为复分解反应。
,其反应类型为复分解反应。
(4)选用![]() 调节pH而不选用
调节pH而不选用![]() 的原因是使用氢氧化钠会引入新的杂质。
的原因是使用氢氧化钠会引入新的杂质。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目