题目内容
 下表是氯化钠和硝酸钾的溶解度(部分):
下表是氯化钠和硝酸钾的溶解度(部分):
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
| KNO3的溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
| NaCl的溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 |
(2)从结晶的方法看,海水晒盐属于______结晶(选填“蒸发”或“降温”),使用该方法的原因是:氯化钠的溶解度受温度影响______(选填“小”或“大”);
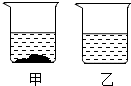
(3)10℃时,在各盛有100g水的甲、乙两烧杯中,分别加入 等质量的氯化钠和硝酸钾固体,充分溶解后,现象如图所示.甲烧杯中加入的物质是______,加入的质量范围为:______.
解:(1)硝酸钾的溶解度随温度的升高逐渐增大,故要将接近饱和的硝酸钾溶液变为饱和溶液,可采取的继续加入硝酸钾、蒸发溶剂、降低温度的方法;
(2)氯化钠的溶解度随温度变化不大,因此使用蒸发结晶的方法获得晶体;
(3)10℃时硝酸钾的溶解度是20.9g,氯化钠的溶解度是35.8g,所以分别加入等质量的氯化钠和硝酸钾固体,充分溶解后,有剩余固体的是硝酸钾,因为硝酸钾的溶解度小于氯化钠的溶解度;而乙烧杯中无固体剩余,说明形成的溶液是不饱和溶液或恰好是饱和溶液,故加入的质量范围为:大于20.9克小于等于35.8克;
故答案为:(1)蒸发溶剂;降低温度;
(2)蒸发;小;
(3)硝酸钾;所加质量大于20.9克小于等于35.8克.
分析:(1)不饱和溶液变为饱和溶液的一般方法是:蒸发溶剂、降低温度、加入溶质,并结合硝酸钾的溶解度随温度变化情况分析解答;
(2)氯化钠的溶解度随温度变化不大,因此使用蒸发结晶的方法获得晶体;
(3)根据10℃时硝酸钾和氯化钠的溶解度并结合图示分析解答.
点评:掌握不饱和溶液、饱和溶液的转化方法,溶解度的概念,并会结合题意分析、解决问题.
(2)氯化钠的溶解度随温度变化不大,因此使用蒸发结晶的方法获得晶体;
(3)10℃时硝酸钾的溶解度是20.9g,氯化钠的溶解度是35.8g,所以分别加入等质量的氯化钠和硝酸钾固体,充分溶解后,有剩余固体的是硝酸钾,因为硝酸钾的溶解度小于氯化钠的溶解度;而乙烧杯中无固体剩余,说明形成的溶液是不饱和溶液或恰好是饱和溶液,故加入的质量范围为:大于20.9克小于等于35.8克;
故答案为:(1)蒸发溶剂;降低温度;
(2)蒸发;小;
(3)硝酸钾;所加质量大于20.9克小于等于35.8克.
分析:(1)不饱和溶液变为饱和溶液的一般方法是:蒸发溶剂、降低温度、加入溶质,并结合硝酸钾的溶解度随温度变化情况分析解答;
(2)氯化钠的溶解度随温度变化不大,因此使用蒸发结晶的方法获得晶体;
(3)根据10℃时硝酸钾和氯化钠的溶解度并结合图示分析解答.
点评:掌握不饱和溶液、饱和溶液的转化方法,溶解度的概念,并会结合题意分析、解决问题.

练习册系列答案
相关题目
下表是氯化钠和硝酸钾在不同温度下的溶解度S(克/100克水),根据此表回答:
(1)50℃时,硝酸钾的溶解度为85.5克/100克水,表示的含义是 .
(2)在60℃时,10克水中加入12克硝酸钾,充分搅拌后所得溶液的质量为 克,该溶液的溶质质量分数为 .(计算结果精确到0.1%)
(3)由表中数据可知,硝酸钾和氯化钠在某温度范围内溶解度相等,这个温度范围是 .
(4)海水制食盐利用蒸发溶剂的方法,其原理是 .
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl的溶解度 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| KNO3的溶解度 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 138.0 |
(2)在60℃时,10克水中加入12克硝酸钾,充分搅拌后所得溶液的质量为
(3)由表中数据可知,硝酸钾和氯化钠在某温度范围内溶解度相等,这个温度范围是
(4)海水制食盐利用蒸发溶剂的方法,其原理是

 (2013?浦口区一模)下表是氯化钠和硝酸钾在不同温度时的溶解度
(2013?浦口区一模)下表是氯化钠和硝酸钾在不同温度时的溶解度