题目内容
下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A.冷却或加入硝酸钾固体都能使接近饱和的硝酸钾溶液达到饱和
B.要从硝酸钾和氯化钠的混合物中提取硝酸钾,可以采用冷却热饱和溶液法结晶提取
C.小红同学认为在20℃时把20克的氯化钠投入50克的水中充分搅拌就能得到28.6%的氯化钠溶液
(2)在30℃时,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为g.
(3)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则X所对应的温度取值范围是.
【答案】分析:(1)使不饱和溶液变为饱和溶液常用的方法是改变温度,加入溶质或蒸发水.使物质结晶的方法选择依据是根据物质溶解度与温度的关系进行;计算溶质的质量分数要分析溶质是否完全溶解.
(2)计算溶液的质量要分析溶质是否完全溶解;
(3)硝酸钾和氯化钠溶解度相同的温度即是判断该段中溶解度的数值是否存在相等的可能.
解答:解:(1)A、因为硝酸钾的溶解度随温度的升高而增大,所以降温可以使不饱和变饱和,加溶质是所有不饱和溶液变饱和溶液的方法.B、因为硝酸钾的溶解度随温度的升高而增大,而且变化很大,所以可以用冷却热饱和溶液法,所以正确.
C、根据溶解度表可知在20℃时,100克水最多溶解36克氯化钠,50克水最多溶解18克,所得溶液溶质的质量分数最大为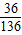 ×100%=26.5%,所以C错误.故选A.
×100%=26.5%,所以C错误.故选A.
(2)根据溶解度表可知在30℃时,100克水最多溶解45.8克硝酸钾,所以溶液的质量为145.8克;
硝酸钾和氯化钠溶解度相同的温度即是判断该段中溶解度的数值是否存在相等的可能,经分析知在20~30℃时这两种物质存在溶解度相同的可能.
所以答案为:
(1)AB;
(2)145.8;
(3)20~30℃.
点评:此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.
(2)计算溶液的质量要分析溶质是否完全溶解;
(3)硝酸钾和氯化钠溶解度相同的温度即是判断该段中溶解度的数值是否存在相等的可能.
解答:解:(1)A、因为硝酸钾的溶解度随温度的升高而增大,所以降温可以使不饱和变饱和,加溶质是所有不饱和溶液变饱和溶液的方法.B、因为硝酸钾的溶解度随温度的升高而增大,而且变化很大,所以可以用冷却热饱和溶液法,所以正确.
C、根据溶解度表可知在20℃时,100克水最多溶解36克氯化钠,50克水最多溶解18克,所得溶液溶质的质量分数最大为
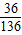 ×100%=26.5%,所以C错误.故选A.
×100%=26.5%,所以C错误.故选A.(2)根据溶解度表可知在30℃时,100克水最多溶解45.8克硝酸钾,所以溶液的质量为145.8克;
硝酸钾和氯化钠溶解度相同的温度即是判断该段中溶解度的数值是否存在相等的可能,经分析知在20~30℃时这两种物质存在溶解度相同的可能.
所以答案为:
(1)AB;
(2)145.8;
(3)20~30℃.
点评:此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
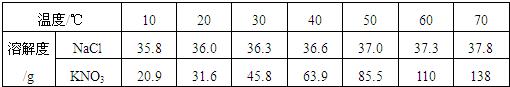
下表是氯化钠和硝酸钾在不同温度下的溶解度S(克/100克水),根据此表回答:
(1)50℃时,硝酸钾的溶解度为85.5克/100克水,表示的含义是 .
(2)在60℃时,10克水中加入12克硝酸钾,充分搅拌后所得溶液的质量为 克,该溶液的溶质质量分数为 .(计算结果精确到0.1%)
(3)由表中数据可知,硝酸钾和氯化钠在某温度范围内溶解度相等,这个温度范围是 .
(4)海水制食盐利用蒸发溶剂的方法,其原理是 .
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl的溶解度 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| KNO3的溶解度 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 138.0 |
(2)在60℃时,10克水中加入12克硝酸钾,充分搅拌后所得溶液的质量为
(3)由表中数据可知,硝酸钾和氯化钠在某温度范围内溶解度相等,这个温度范围是
(4)海水制食盐利用蒸发溶剂的方法,其原理是
 (2013?浦口区一模)下表是氯化钠和硝酸钾在不同温度时的溶解度
(2013?浦口区一模)下表是氯化钠和硝酸钾在不同温度时的溶解度