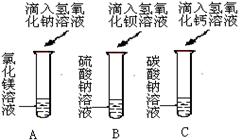
题目内容
(5分)同学们利用如下装置验证CO2能与NaOH反应。(装置气密性良好)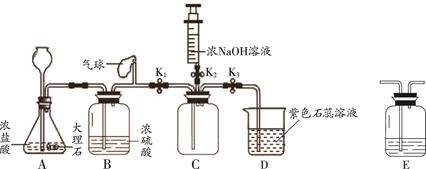
(1)打开K1、K3,关闭K2,当D中出现__________的现象时,可确定C中收集满CO2
(2)C中收集满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生了反应.
①小明发现此装置有明显不足,认为应该在 (填装置字母序号)之间增加洗气瓶E,其作用是 。
②改进装置后,小红认为要想证明CO2与NaOH发生反应,还应利用上述装置补充一个对比实验,实验方案是 。
(1)紫色石蕊溶液变红; (2)①A、B ;除去HCl气体;②将注射器中的5mL水压入到装置C中,重复实验,观察到液体倒吸的量小于推入NaOH实验时的量,说明CO2与NaOH发生反应.
解析试题分析:(1)A中二氧化碳能与水反应生成碳酸,碳酸可使紫色石蕊试液变红色;(2)①A中用浓盐酸,使生成的二氧化碳中含有氯化氢气体,应在A和B之间增加装有饱和碳酸氢钠溶液的洗气瓶,以除去除去挥发出的HCl气体;②将注射器中的5mL水压入到装置C中,重复实验,观察到液体倒吸的量小于推入NaOH实验时的量,说明CO2与NaOH发生反应.
考点:实验探究CO2能与NaOH反应

下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。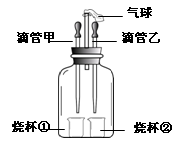
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是_______ _ 。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| | 滴管甲 | 烧杯① | 滴管乙 | 烧杯② |
| 试剂 | H2O | | | Mg |
使用浓硫酸时要十分小心,浓硫酸有强烈的 !所以,不要将浓硫酸沾到皮肤或衣服上。为了加深记忆,小丽同学用下图形象地总结了硫酸能与5类物质发生反应。请你根据要求完成下列问题。
(1)将紫色石蕊溶液滴入稀硫酸溶液中,紫色石蕊溶液遇稀硫酸变成 ;
(2)稀硫酸能够除铁锈(铁锈的主要成分Fe2O3),除锈后溶液颜色的变化情况是 ,
写出反应的化学方程式 ;
(3)为了验证反应⑤能够发生,应选择的物质是 ;
| A.NaCl溶液 | B.NaOH溶液 |
| C.Ba(NO3 )2溶液 | D.MgCl2溶液 |
分类法是学习化学的重要思想方法,依据同类物质性质的相似性,可以帮助我们做到举一反三。现有下列三组物质:
A.空气、胆矾、冰水、蔗糖
B.KOH、H2SO4、Ca(OH)2、Ba(OH)2
C.NH4Cl、Na2CO3、SO2、Na2SO4
(1)填写下表空白
| 组 别 | A组 | B组 | C组 |
| 分类标准 | 纯净物 | 碱 | |
| 不属于上述分类标准的物质 | 空气 | | SO2 |
(2)请仿照检验CO2的反应,写出SO2与石灰水的反应方程式 。
(3)下列各组物质间均能反应,写出③、④反应的化学方程式.。
①硫酸铜溶液和氢氧化钠溶液 ②碳酸钠溶液与硫酸
③氢氧化钠溶液与盐酸 。
④硝酸银溶液和氯化锌溶液 。
(4)NaOH溶液与CuSO4溶液能够反应,实质是因为它们在水中解离出来的OH-和Cu2+结合生成了Cu(OH)2沉淀。结合发生复分解反应的条件,请回答:Na2CO3溶液与H2SO4溶液能够反应的实质是它们在水中解离出 离子结合生成 。