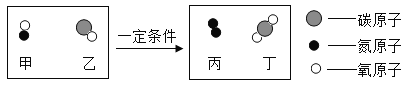
��Ŀ����
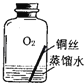
����Ŀ����1����ͼ��ʵ������ȡ�����һЩװ�ã���ͼ�ش�
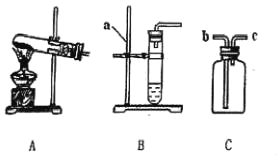
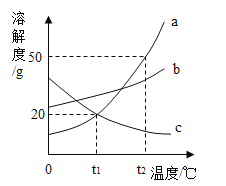
��ͼB������a��������_____��
���ø��������ȡ�����ķ���װ����_____������ţ�����Ӧ�Ļ�ѧ����ʽ��_____������Cװ���ռ�����������ʱ��Ӧ�������ǵ�ľ������_____������b������c�����˵��ܿڣ���ľ����ȼ��˵������������
��2��С���ڰ���ʦ����ʵ����ʱ������һƿδ�ܷ���������ع��壬����ɷ�������¼��裬������ʦ��ָ���½���ʵ��̽����
[��������]
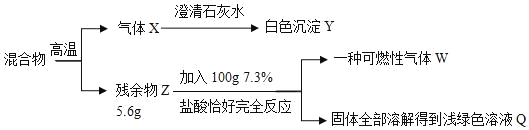
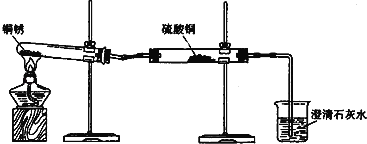
�������������������ƵĻ�ѧ�������ơ����û�ѧ����ʽ�����������ر��ʵ�ԭ����_____��
��̼�����Һ�ʼ��ԣ��Ȼ�����Һ���Ȼ�����Һ�����ԡ�
[�������]������l��ֻ���������أ�������������غ�̼��أ������ֻ��̼��ء�
[����ʵ��]��
ʵ��������� | ʵ������ | ʵ����� |
��ȡ������Ʒ���Թ��У���ˮ�ܽ⣬����������Ȼ�����Һ�������á� | _____ | �������ȷ |
��ȡ�����ϲ���Һ���μ�_____��Һ�� | _____ |
[��������]��������м�������Ȼ�����Һ��������_____��
[��չӦ��]����ȫ���ʵ���������Ҳ�����ü�ֵ����̼��ص���ɻ����ʿ�����ƿ���ʵ��Լ���ũҵ�ϵ���;��_____��
���𰸡�����̨ A 2KMnO4![]() K2MnO4+MnO2+O2�� c 2KOH+CO2�TK2CO3+H2O ������ɫ���� ��̪ ��Һ����ɫ ���鲢�ҳ�ȥ̼��� �����طʡ���
K2MnO4+MnO2+O2�� c 2KOH+CO2�TK2CO3+H2O ������ɫ���� ��̪ ��Һ����ɫ ���鲢�ҳ�ȥ̼��� �����طʡ���
��������
��1����ͼB������a������������̨��
�������̨��
���ø��������ȡ������Ҫ���ȣ�����װ����A����Ӧ�Ļ�ѧ����ʽ�ǣ�2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
����Cװ���ռ����������������ܶȱȿ�����Ӧ�ô�b����ͨ�룬����ʱ��Ӧ�������ǵ�ľ������c�˵��ܿڣ���ľ����ȼ��˵������������
���A��2KMnO4![]() K2MnO4+MnO2+O2����c��
K2MnO4+MnO2+O2����c��
��2�����������ر��ʣ�����Ϊ�ܺͿ����еĶ�����̼��Ӧ����̼��غ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��2KOH+CO2�TK2CO3+H2O��
���2KOH+CO2�TK2CO3+H2O��
��[����ʵ��]
��ȡ������Ʒ���Թ��У���ˮ�ܽ⣬����������Ȼ�����Һ��������ɫ����������Ϊ�Ȼ�����̼��ط�Ӧ������̼�ᱵ������˵����Һ�к���̼��أ�
��ȡ�����ϲ���Һ���μӷ�̪��Һ����̪��Һ����ɫ��˵����Һ�в������������أ�ʵ�����������ʾ��
ʵ��������� | ʵ������ | ʵ����� |
��ȡ������Ʒ���Թ��У���ˮ�ܽ⣬����������Ȼ�����Һ�������á� | ������ɫ���� | �������ȷ |
��ȡ�����ϲ���Һ���μӷ�̪��Һ�� | ��Һ����ɫ |
[��������]
������м�������Ȼ�����Һ�������Ǽ��鲢�ҳ�ȥ̼��أ���ֹ�Լ����������ز���Ӱ�졣
������鲢�ҳ�ȥ̼��ء�
[��չӦ��]
̼����к��м�Ԫ�أ���ƿ���ʵ��Լ���ũҵ�ϵ���;�������طʡ�
��������طʡ�

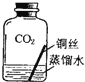
����Ŀ�������г�����ͭ��Ʒ��������������ϣ�ͬѧ�����ʵ���ͭ�����������̽�����
̽���һ����֤ͭ������
���������ϡ���ͭ��Ϊ��ɫ������Ҫ�ɷ���Cu2��OH��2CO3���ڰ�ɫ������ͭ��ĩ��ˮ�ܱ�Ϊ��ɫ����̼����ϡ���ᷴӦ��������ͭΪ��ɫ���壬����ϡ���ᷴӦ��������ͭ��Һ��
������ʵ��1��ͬѧ���������ͼ��ʾװ�ò�����ʵ�飮
ʵ��]�� | ʵ������ | ʵ����� |
�ٰ���ͼ��װ������װ��ҩƷ�� �ڼ���ͭ�⣬ֱ�����������������ֹͣ���ȣ� | ��ɫ�����Ϊ��ɫ������ͭ��ĩ��Ϊ��ɫ���ձ���Һ�����ǣ� | ����ͭ�����ɵ������� �� ͭ���� Ԫ����ɣ� �ձ��з�����Ӧ�Ļ�ѧ����ʽΪ �� |
����ȴ�����Թ��й��� ��������ϡ���ᣬ�Լ��ȣ� | ��ɫ�����ܽ⣬��Һ�� Ϊ��ɫ�� |
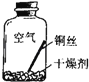
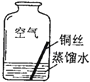
������ʵ��2��ͬѧ�ǽ����������4��ʵ�飬ÿ��۲�һ������һ��ʱ�����ֻ��ʵ��4�е�ͭ˿�����ˣ�����ˮ�Ӵ��IJ�����������ԣ�
��� | ʵ������ | ʵ����� | ʵ�鷴˼ |
ʵ��1 |
| �ڸ��ﻷ���У�ͭ�������� | ��1��ʵ��2��3��ʹ�õ��Ǿ���к�Ѹ����ȴ������ˮ����ԭ���� �� ��2�����Ҫ֤��ͭ����Ŀ����Ƿ��������̼��Ũ���йأ�����Ҫ�����һ��ʵ�������� |
ʵ��2 |
| ||
ʵ��3 |
| ||
ʵ��4 |
| ͭ�����������
|