题目内容
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下:(原料石灰石中含的杂质主要是MgCO3、MgSO4 和Al2O3)
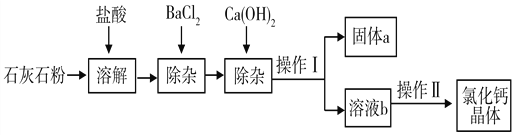
(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为_____________________;
(2)加入BaCl2是为了除去_________________;(填化学式)
(3)操作Ⅱ的具体步骤为___________________ 、冷却结晶;
(4)固体a的成分中含有的物质有_____________________(填化学式)。
【答案】 Al2O3 +6HCl==2AlCl3 +3H2O MgSO4 蒸发浓缩 BaSO4、Mg(OH)2、Al(OH)3 (写两种即可得分)
【解析】(1)金属氧化物与盐酸反应生成盐和水。(2)加入BaCl2是为了将MgSO4 转化为硫酸钡沉淀而除去。(3)从溶液中分离出溶质,可用蒸发结晶法,即蒸发浓缩、冷却结晶。(4)固体a是过滤出的沉淀,化学反应前后元素的种类不变,故MgCO3、MgSO4 和Al2O3转化成的沉淀有Mg(OH)2、BaSO4、Al(OH)3 。

【题目】某兴趣小组为探究CaCl2和HCl的混合溶液中CaCl2的质量分数,分别取40g混合溶液,依次加入一定量的Na2CO3溶液,观察到实验中既有气体又有沉淀生成,其中生成沉淀的化学方程式为:Na2CO3+CaCl2![]() CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:
CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | m | 0 | 1 | 2 | 3 | 4 | 4 |
(1)上表中m的值为_______;
(2)计算原混合溶液中CaCl2的质量分数________;
(3)第⑦次实验后所得溶液中的溶质是________________________。