��Ŀ����
��������������������������أ�
��1����������ͭ������㷺ʹ�õ����ֽ�����������ģ�������������ֽ������Ⱥ�����˳���� �����й�
A���ؿ��н����ĺ���������B�������Ļ�ԡ�������C���������۵�
��2������Ʒ�ڳ�ʪ�Ŀ�����������������Ϊ�����Ϳ����е� �� ������Ӧ��
��3��ij����������CuSO4��ZnSO4��FeSO4�ķ�Һ�����´��������йؽ����ͻ���������ͼ��������ͼ�����ͼ�ش�
a������ٺ͢���Ҫ���еIJ���Ϊ ������A��һ���е�����Ϊ
b���������п�۱��������ԭ����
c�����鲽����м����ϡ�����Ƿ������ķ�����
d����д��������з����Ļ�ѧ��Ӧ����ʽ
e����ȡ20g����C�����ձ��У������м���100gϡ���ᣬ����ǡ����ȫ��Ӧ����Ӧ���������ձ���ʣ�����ʵ�������Ϊ119.6g���������ձ��������������ܽ���Բ��ƣ����Լ���������Һ�����ʵ�����������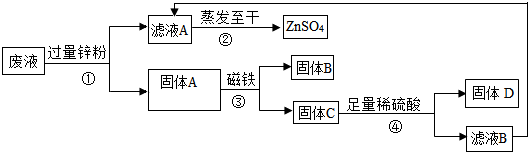
��1����������ͭ������㷺ʹ�õ����ֽ�����������ģ�������������ֽ������Ⱥ�����˳����
A���ؿ��н����ĺ���������B�������Ļ�ԡ�������C���������۵�
��2������Ʒ�ڳ�ʪ�Ŀ�����������������Ϊ�����Ϳ����е�
��3��ij����������CuSO4��ZnSO4��FeSO4�ķ�Һ�����´��������йؽ����ͻ���������ͼ��������ͼ�����ͼ�ش�
a������ٺ͢���Ҫ���еIJ���Ϊ
b���������п�۱��������ԭ����
c�����鲽����м����ϡ�����Ƿ������ķ�����
d����д��������з����Ļ�ѧ��Ӧ����ʽ
e����ȡ20g����C�����ձ��У������м���100gϡ���ᣬ����ǡ����ȫ��Ӧ����Ӧ���������ձ���ʣ�����ʵ�������Ϊ119.6g���������ձ��������������ܽ���Բ��ƣ����Լ���������Һ�����ʵ�����������

���㣺�������˳����Ӧ��,�й��������������ļ���,�����Ļ�ѧ����,������ʴ�������������,���ݻ�ѧ��Ӧ����ʽ�ļ���
ר�⣺�������������
��������1���������еĽ�����֪ʶ���з����������Ļ��Խǿ��ұ���ij̶�Խ�ѣ����õ�Խ����
��2����������������Ǹ�����������ˮͬʱ�Ӵ���������Һ��������Һ������Һ�ܴٽ��������⣮
��3�����ݷ�Һ�гɷ�CuSO4��ZnSO4��FeSO4 ����֪���������п���ǰ�����п��Ӧ�����ʶ���Ӧ��������п�����ᷴӦ�ķ���ʽ���ǣ�������м����ϡ������Ϊ�˺�п��Ӧ����Ҫ���Ƿ���û��Ӧ��п���У�����Ӧ����Һ�����ʵ������������������Ӧ�����Һ�Ȼ�����Һ���Ȼ��Ƶ�������
��2����������������Ǹ�����������ˮͬʱ�Ӵ���������Һ��������Һ������Һ�ܴٽ��������⣮
��3�����ݷ�Һ�гɷ�CuSO4��ZnSO4��FeSO4 ����֪���������п���ǰ�����п��Ӧ�����ʶ���Ӧ��������п�����ᷴӦ�ķ���ʽ���ǣ�������м����ϡ������Ϊ�˺�п��Ӧ����Ҫ���Ƿ���û��Ӧ��п���У�����Ӧ����Һ�����ʵ������������������Ӧ�����Һ�Ȼ�����Һ���Ȼ��Ƶ�������
����⣺��1�������֪���ڽ������˳����У����ֽ����Ļ������������ͭ��ͭ�Ļ��������ͭ���õ����磬������ã������������õ�ʱ���ں�˵���������ģ���������õ��Ⱥ�˳������������أ�ͬʱ��������۵�Ҳ�أ��������������йأ�
��2�������Ϳ����е�������ˮ����������Ӧ�����⣮
��3��a������ٺܶ͢��ǽ������Һ��ֿ�������Ϊ���ˣ�п�����û�����ͭ�е�ͭ����������������Ӧ��������п����������п�۹���������п����ȫ�û�����ͭ�е�ͭ�����������е���������A��һ����ͭ������п��
b�����ݷ�Һ�гɷ�CuSO4��ZnSO4��FeSO4 ����֪���������п���ǰ�����п��Ӧ�����ʶ���Ӧ����п����������ͭ��Ӧ��п����������������Ӧ�����Բ������п�۱��������ԭ���ǽ���Һ�е�Cu2+��Fe2+ȫ���û�������
c��������м����ϡ������Ϊ�˺�п��Ӧ����Ҫ���Ƿ���û��Ӧ��п���У����Բ�����м����ϡ�����Ƿ������ķ����ǣ�ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������
d������п�����ᷴӦ��������������������п��д������ʽ���ɣ�
e�������ɵ�����п������Ϊx���μӷ�Ӧ��п������Ϊy��
Zn+H2SO4=ZnSO4+H2��
65 161 2
y x 0.4g
=
y=13g
=
x=32.2g
������Һ�����ʵ���������Ϊ��
��100%=28.6%��
�ʴ�Ϊ����1��B����2��������ˮ��������3��a�����ˣ�ͭ������п��b������Һ�е�Cu2+��Fe2+ȫ���û�������c��ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������d��Zn+H2SO4=ZnSO4+H2����e��28.6%
��2�������Ϳ����е�������ˮ����������Ӧ�����⣮
��3��a������ٺܶ͢��ǽ������Һ��ֿ�������Ϊ���ˣ�п�����û�����ͭ�е�ͭ����������������Ӧ��������п����������п�۹���������п����ȫ�û�����ͭ�е�ͭ�����������е���������A��һ����ͭ������п��
b�����ݷ�Һ�гɷ�CuSO4��ZnSO4��FeSO4 ����֪���������п���ǰ�����п��Ӧ�����ʶ���Ӧ����п����������ͭ��Ӧ��п����������������Ӧ�����Բ������п�۱��������ԭ���ǽ���Һ�е�Cu2+��Fe2+ȫ���û�������
c��������м����ϡ������Ϊ�˺�п��Ӧ����Ҫ���Ƿ���û��Ӧ��п���У����Բ�����м����ϡ�����Ƿ������ķ����ǣ�ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������
d������п�����ᷴӦ��������������������п��д������ʽ���ɣ�
e�������ɵ�����п������Ϊx���μӷ�Ӧ��п������Ϊy��
Zn+H2SO4=ZnSO4+H2��
65 161 2
y x 0.4g
| 65 |
| y |
| 2 |
| 0.4g |
y=13g
| 161 |
| x |
| 2 |
| 0.4g |
x=32.2g
������Һ�����ʵ���������Ϊ��
| 32.2g |
| 100g+13g-0.4g |
�ʴ�Ϊ����1��B����2��������ˮ��������3��a�����ˣ�ͭ������п��b������Һ�е�Cu2+��Fe2+ȫ���û�������c��ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������d��Zn+H2SO4=ZnSO4+H2����e��28.6%
������������Ҫ�����˻�ѧ����ʽ����д������ȷ����ʵ�鷽������ݣ���ɴ��⣬�������ݽ������˳����������У�

��ϰ��ϵ�д�
�����Ŀ
�������ֲ������Խ���ˮ��Ӳ�ȣ�������
| A������ | B������ | C������ | D������ |
 ��ͼ��ʵ���Ҽ�������غ�����صĻ������ȡ���ռ�������װ��ͼ
��ͼ��ʵ���Ҽ�������غ�����صĻ������ȡ���ռ�������װ��ͼ ���������ʵ����ܽ�����ش����⣺
���������ʵ����ܽ�����ش����⣺