题目内容
【题目】实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硝酸和铁粉分离回收银和铜,设计如下方案:①先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为银、铜和铁.
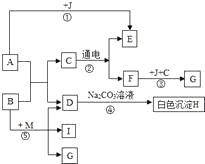
②再对滤渣A按如下流程图处理:

(1)方案①先在废液中加入过量的铁粉,过量的目的是__(填字母)
A.加快反应速度 B.铁的金属活动性较强 C.使反应充分进行
(2)写出CuO与H2SO4反应的化学方程式__.
(3)写出滤液D与适量Fe反应的化学方程式__、__.
(4)含有硫酸亚铁的滤液有滤液C和__(填框图中字母).
(5)在过滤操作中要用到玻璃棒,其作用是__;如果过滤时发现滤液浑浊,在滤纸不破损的前提下,你认为滤液的浑浊的原因可能是__(写一点).
【答案】 C CuO+H2SO4═CuSO4+H2O Fe+CuSO4═Cu+FeSO4 Fe+H2SO4═FeSO4+H2↑ 滤液E 引流 过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯
【解析】(1)铁与硝酸银反应生成硝酸亚铁和银,铁和硝酸铜反应生成硝酸亚铁和铜,向含有硝酸银、硝酸铜的废液中加入过量的铁粉,所得固体为铜、银、铁;加入过量的铁粉,过量的目的是使硝酸银、硝酸铜充分接触反应;(2)CuO与H2SO4反应生成硫酸铜和水,化学方程式为:CuO+H2SO4═CuSO4+H2O;(3)由流程图可推知滤液D中溶质为生成的硫酸铜和过量的硫酸;加入铁后,铁与硫酸反应生成硫酸反应和氢气,方程式为Fe+H2SO4═FeSO4+H2↑,铁和硫酸铜反应生成铜和硫酸亚铁,方程式为Fe+CuSO4═Cu+FeSO4 ;(4)含有硫酸亚铁的滤液有滤液C和滤液E;(5)在过滤操作中要用到玻璃棒,其作用是引流;如果过滤时发现滤液浑浊,在滤纸不破损的前提下,你认为滤液的浑浊的原因可能是过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯,或者承接滤液的烧杯不干净。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案【题目】袋装食品中常用一种“双吸剂”保持,主要成分是铁粉和生石灰,同学们对一久置的双吸剂固体样品很好奇,设计了如下实验进行探究.
【提出问题】久置“双吸剂”的成分是什么?
【做出猜想】久置“双吸剂”中可能有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有_______.再用磁铁反复吸引后,残留固体用于后续探究活动.
【实验探究2】
实验操作 | 实验现象 | 实验结论 |
取少量探究实验1的残留固体放入试管中,加入蒸馏水。 | 试管外壁不发烫 | 固体中一定没有 _____________ |
【实验探究3】
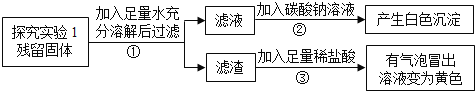
【实验结论】
(1)步骤②产生白色沉淀,说明久置的“双吸剂”中含有_________,其反应的化学方程式:___________________。
(2)步骤③有气泡冒出,溶液变为黄色,说明久置的“双吸剂”中含有_______和______。所涉及的两个反应的化学方程式为:_______________;_____________________。