题目内容
【题目】某同学在实验室完成稀硫酸与NaOH溶液进行中和反应的实验。

(1)写出该反应的化学方程式________
(2)由图甲推测,该同学是将______中,(从A “氢氧化钠溶液加入到稀硫酸”或B “稀硫酸加入到氢氧化钠溶液”选择,用序号填空),
(3)图甲中B点的含义是______, C点对应溶液中的溶质为_______。
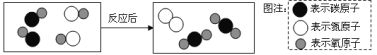
(4)由图乙可知,该反应的微观实质是______结合成水分子。
【答案】H2SO4+2NaOH=Na2SO4+2H2O B 硫酸与氢氧化钠恰好完全反应 Na2SO4和H2SO4 H+与OH-
【解析】
(1)某同学在实验室完成的是稀硫酸与NaOH溶液进行中和反应的实验,所以反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O ,故填:H2SO4+2NaOH=Na2SO4+2H2O;
(2)由图甲知起点的溶液pH>7,所以溶液呈碱性,最终溶液的pH<7,所以溶液呈酸性,所以此实验是将稀硫酸加入氢氧化钠溶液中的,故填:B;
(3)图甲中B点的pH=7,说明此时溶液呈中性,说明酸与碱此时恰好完全反应,故填:硫酸与氢氧化钠恰好完全反应;
(4)由图乙可知,在此反应中,反应前的硫酸根离子和钠离子仍然存在,而反应前的氢离子和氢氧根离子没有了,在反应后多出了水分子,所以反应的实质是氢离子与氢氧根离子结合生成水分子的过程,故填:H+与OH-。

练习册系列答案
相关题目