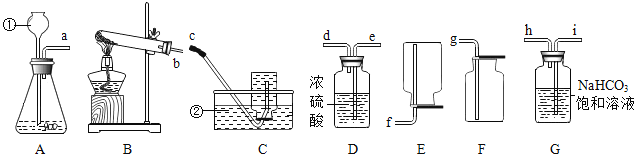
题目内容
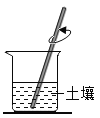
【题目】我国海水晒盐的历史悠久。粗盐中含有不溶性泥沙、可溶性 CaCl2、MgCl2 等杂质。学习小组设计了如下方案提纯粗盐:
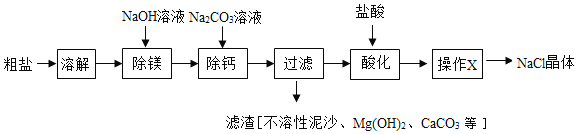
(1)用化学方程式表示 Na2CO3 溶液的作用:______。
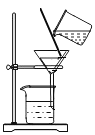
(2)“过滤”中玻璃棒的作用为______;“操作 X”的名称为______。
(3)“酸化”过程中有气体生成的反应的化学方程式:______。
(4)酸化时加入过量的盐酸,对氯化钠晶体的纯度无影响,理由是______。
(5)若不考虑实验过程中的损耗,最终所得氯化钠晶体质量______(选填“大于”“等于”、“小于”)粗盐中氯化钠质量。
【答案】![]() 引流 蒸发
引流 蒸发 ![]() 盐酸具有挥发性,蒸发时能将盐酸挥发掉 大于
盐酸具有挥发性,蒸发时能将盐酸挥发掉 大于
【解析】
(1)碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,从而除去氯化钙,该反应的化学方程式为:![]() ;
;
(2)过滤中玻璃棒的作用是:引流;
由流程图可知,氯化钠溶液经过操作X后,变为氯化钠晶体,故操作X为蒸发;
(3)“酸化”过程中,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,有气体生成,该反应的化学方程式为:![]() ;
;
(4)盐酸具有挥发性,蒸发时能将盐酸挥发掉,故酸化时加入过量的盐酸,对氯化钠晶体的纯度无影响;
(5)因为反应过程中有氯化钠生成,故若不考虑实验过程中的损耗,最终所得氯化钠晶体质量大于粗盐中氯化钠质量。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目