题目内容
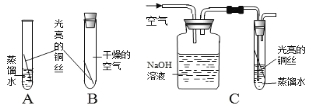
【题目】(7分)下面所示为实验室中常见气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题:

(1)若以过氧化氢溶液为原料(二氧化锰作催化剂)在实验室中制备并收集干燥的氧气。
①所选仪器的连接顺序为_______________(填写仪器序号字母)。
②生成氧气时,仪器A中发生反应的化学方程式为 。
(2)若用锌和稀硫酸反应制取氢气,并用来测定某不纯的氧化铜样品的纯度(杂质为少量单质铜),所选仪器的连接顺序为:A→D1→C→D2→D3。(已知:CuO+H2![]() Cu+H2O;D1、D2、D3为3个浓硫酸洗气瓶)
Cu+H2O;D1、D2、D3为3个浓硫酸洗气瓶)
①仪器D1的作用是_____________________________________________。
②仪器A中发生反应的化学方程式是 。
③反应完成后,装置D2中浓硫酸的质量增重1.8g,则氧化铜样品的纯度为 。若不连接D1,则计算出氧化铜样品的纯度将会_____________(填“偏大”、“偏小”或“基本一致”)。
④若通过 的方法,即使不连接D1,计算出氧化铜样品的纯度也会基本一致。
【答案】(1)①ADE;②2H2O2MnO22H2O+O2↑;(2)①干燥氢气;
②Zn+H2SO4====ZnSO4+H2↑;③80%;偏大;④测量反应前后C装置玻璃管中固体质量减少。
【解析】
试题分析:(1) ①用过氧化氢和二氧化锰制取氧气应用固体和液体在常温下制取气体的装置,所以应用装置A。浓硫酸有吸水性,可作干燥剂,所以可用装置D。氧气的密度比空气大,且题目要求收集干燥的氧气,所以应选向上排空气法收集氧气,使用装置E。所以应选择ADE三个装置完成实验。
②仪器A中,过氧化氢在二氧化锰的催化作用下发生分解反应生成水和氧气;反应的化学方程式为2H2O2MnO22H2O+O2↑;
(2)若并用来测定某不纯的氧化铜样品的纯度(杂质为少量单质铜),所选仪器的连接顺序为:A→D1→C→D2→D3。(已知:CuO+H2![]() Cu+H2O;D1、D2、D3为3个浓硫酸洗气瓶)
Cu+H2O;D1、D2、D3为3个浓硫酸洗气瓶)
①仪器D1的作用是除去氢中的水蒸气;。
②仪器A中用锌和稀硫酸反应制取氢气,发生反应的化学方程式为Zn+H2SO4====ZnSO4+H2↑。
③反应完成后,装置D2中浓硫酸的质量增重1.8g,即氧化铜和氢气反应生成水的质量为1.8g。根据水和氧化铜的质量关系可求出氧化铜的质量。具体过程如下:
解:设氧化铜的质量为x;
CuO+H2![]() Cu+H2O
Cu+H2O
80 18
x 1.8g
80:18=x:1.8g
x=8g
所以氧化铜的纯度为:![]() ×100%=80%
×100%=80%
若不连接D1,则测出的水的质量会偏大,所以计算出氧化铜样品的纯度将会偏大。
④若通过测量反应前后C装置玻璃管中固体减少的质量(氧化铜中含氧元素的质量),可以不连接D1,计算出氧化铜样品的纯度也会基本一致。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案