题目内容
【题目】草木灰是一种农家肥,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等。化学兴趣小组为测定某草木灰样品中的有效成分,取50g草木灰于烧杯中,不断滴入硫酸溶液,当滴入30g硫酸溶液时,不再有气泡产生,此时烧杯中的残余混合物的质量为77.8g。(假设草木灰的其他成分不含钾元素且不与酸反应)
请计算回答:
(1)草木灰的主要成分所属的物质类别为____________(填“酸、碱或盐”)。
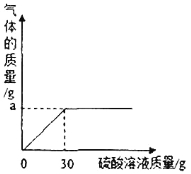
(2)如图表示反应过程中放出的气体质量与加入硫酸溶液的关系曲线,请求出图中纵坐标上a点数值:a=________________g;
(3)计算草木灰样品中碳酸钾的质量分数。(要求写出计算过程)
(4)通过其他实验,测得该50g草木灰中还含的硫酸钾质量为8.7g,氯化钾的质量为1.49g,则该50g草木灰样品中钾元素的质量为__________g。
【答案】(1)盐;(2)2.2(3)13.8%(4)8.58
【解析】
试题分析:(1)根据题意可知,“草木灰是一种农家肥,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等”。其中的碳酸钾,还有硫酸钾,氯化钾均是由金属离子和酸根离子构成的化合物,属于盐类。
(2)a点表示生成气体的质量的最大值。根据题意可知:该气体为碳酸钾与硫酸反应生成的二氧化碳气体。其质量为:50g(草木灰)+30g(硫酸溶液)—77.8g(残余混合物)=2.2 g。所以a=2.2 g;
(3)根据题意可知:已知量为生成二氧化碳的质量;未知量为样品中碳酸钾的质量分数。
解题思路:可根据二氧化碳与碳酸钾在反应中的质量,求出碳酸钾的质量,进一步求出其在样品中的质量分数。具体过程如下:
解:设草木灰样品中碳酸钾的质量为x
K2CO3+H2SO4=K2SO4+CO2↑+H2O
138 44
x 2.2g
138:44=x:2.2g
解得:x=6.9g
碳酸钾的质量分数=![]() ×100%=13.8%
×100%=13.8%
答:草木灰样品中碳酸钾的质量分数为13.8%
(4)草木灰中的钾元素是碳酸钾、硫酸钾和氯化钾三种物质中的钾元素的质量和。可分别根据三种物质的化学式求出其中所含钾元素的质量。具体解题过程如下:
6.9g碳酸钾(K2 CO3)中含钾元素的质量为:6.9g×(![]()
![]() ×100%)=3.9g;
×100%)=3.9g;
8.7g硫酸钾(K2 SO4)中含钾元素的质量为:8.7g×(![]() ×100%)=3.9g;
×100%)=3.9g;
1.49g氯化钾(KCl)中含钾元素的质量为:1.49g×(![]() ×100%)=0.78g;
×100%)=0.78g;
草木灰样品中钾元素的质量为3.9g+3.9g+0.78g=8.58 g。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案