题目内容
【题目】某碳酸钠样品,可能含有碳酸钾、碳酸钙、硫酸铜、氯化钾中的一种或几种杂质:为确定其成分,进行如下实验
(1)取少量该粉末于试管中,加入足量水充分溶解,得到无色澄清溶液。向该溶液中加入适量硝酸银溶液,有白色沉淀产生,再加入足量稀硝酸充分反应后,部分白色沉淀消失;
(2)另取10.6g该样品粉未于烧杯中,加水使其完全溶解,再加入50g一定溶质质量分数的稀盐酸,恰好完全反应,生成4g气体。下列说法中不正确的是( )
A.杂质中一定不含硫酸铜和碳酸钙B.杂质中一定含有氯化钾和碳酸钾
C.所用稀盐酸的溶质质量分数为14.6%D.该包粉末的组成有两种可能
【答案】BC
【解析】
取少量该粉末于试管中,加入足量水充分溶解,得到无色澄清溶液,可知该粉末一定不含硫酸铜和碳酸钙;向该溶液中加入适量硝酸银溶液,有白色沉淀产生,再加入足量稀硝酸充分反应后,部分白色沉淀消失,说明沉淀有氯化银和碳酸银,则该粉末一定含有氯化钾,可能含有碳酸钾。另取10.6g该样品粉未于烧杯中,加水使其完全溶解,再加入50g一定溶质质量分数的稀盐酸,恰好完全反应,生成4g气体。假设10.6g该样品粉未全部为碳酸钠,根据反应方程式,完全反应时产生的二氧化碳为![]() ,4.4g>4g,所以10.6g该样品粉未不可能全是碳酸钠,除了一定含有氯化钾外,还可能含有碳酸钾,因为相同质量的碳酸钠和碳酸钾,碳酸钾产生的二氧化碳气体比碳酸钠的少;
,4.4g>4g,所以10.6g该样品粉未不可能全是碳酸钠,除了一定含有氯化钾外,还可能含有碳酸钾,因为相同质量的碳酸钠和碳酸钾,碳酸钾产生的二氧化碳气体比碳酸钠的少;
设50g一定溶质质量分数的稀盐酸中氯化氢的质量为X。
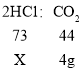
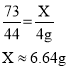
该稀盐酸的溶质质量分数为![]() 。
。
A、杂质中一定不含硫酸铜和碳酸钙,A正确;
B、杂质中一定含有氯化钾,可能含有碳酸钾,B不正确;
C、所用稀盐酸的溶质质量分数约为13.3%,不是14.6%,C不正确;
D、该包粉末的组成有两种可能:一是碳酸钠和氯化钾;二是碳酸钠、氯化钾和碳酸钾,D正确。故选BC。