题目内容
【题目】一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g, 对固体充分加热,测得固体质量随反应时间变化的曲线见下图。
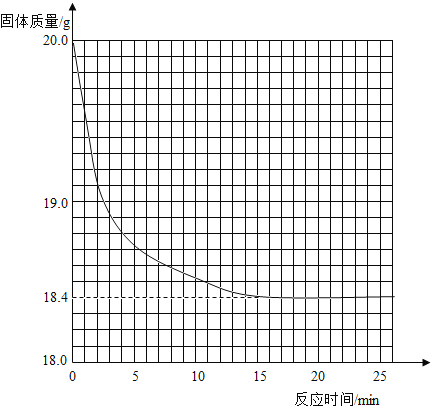
(1)生成氧气的总质量___________g(精确到小数点后一位).
(2)求样品中KMnO4的质量分数(写出计算过程)____________.
(3)某同学为计算反应后固体中MnO2的质量分数,计算如下:
∵已计算到原混合物中KMnO4的质量(用“M”表示)
∴反应后固体中的MnO2,的质量分数=![]()
小华对上述计算过程提出了质疑,请指出其中的错误________。
(4)请画出在实验过程中MnO2的质量随时间变化的坐标图。_______

【答案】1.6g 79%(详见解析) 没有计算出生成的二氧化锰的质量,反应后的固体质量是18.4g而不是20g 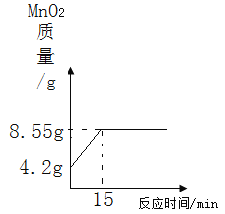
【解析】
(1)根据质量守恒定律得知,生成的氧气的质量为:20g-18.4g=1.6g;
(2)设参与反应的高锰酸钾的质量为x,生成二氧化锰的质量为y。
2KMnO4![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
316 87 32
x y 1.6g
![]() x =15.8g;
x =15.8g;
![]() y=4.35g;
y=4.35g;
样品中高锰酸钾的质量分数=![]() ;
;
(3)从式子中不难看出,该同学计算的是原固体中二氧化锰的质量分数,反应后固体是18.4g,既有原有的二氧化锰,也有生成的二氧化锰,故答案为:没有计算出生成的二氧化锰的质量,反应后的固体质量是18.4g而不是20g;
(4)原混合物中二氧化锰的质量=20g-15.8g=4.2g,反应后固体二氧化锰的质量=4.2g+4.35g=8.55g。所以实验过程中MnO2的质量随时间变化的坐标图如图: 。
。

练习册系列答案
相关题目