题目内容
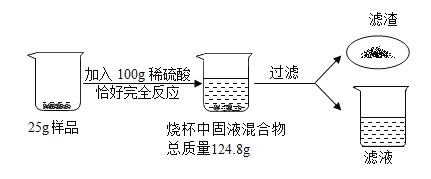
【题目】某化学兴趣小组为测定某黄铜样品(铜锌合金)中铜的含量,进行如下图所示的实验。根据以下信息回答下列问题:
(1)写出实验中发生反应的化学方程式_____。
(2)根据已知条件列出求解生成参加反应的锌质量(X)的比例式_____。
(3)该黄铜样品中铜的质量分数为_____。
(4)若要使所得滤液中溶质的质量分数为10%,需加入水的质量为_____。
(5)若用98%的浓硫酸配制所用的稀硫酸,则需要浓硫酸的的质量为_____。
(6)若工业上用含Cu2S 80%的辉铜矿111t(炼制过程中辉铜矿的损失率为20%),能炼出上述黄铜的质量为_____。
【答案】![]() 65/2=x/0.2g 74% 54.7g 10g 76.8t
65/2=x/0.2g 74% 54.7g 10g 76.8t
【解析】
(1)实验锌和稀硫酸反应生成硫酸锌和氢气,发生反应的化学方程式:![]() ,故填:
,故填:![]() ;
;
根据质量守恒定律可得,生成的氢气的质量为25g+100g-124.8g=0.2g
设锌的质量为x,硫酸锌的质量为y,硫酸中溶质的质量为z
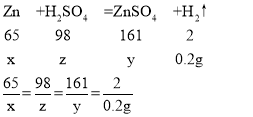
x=6.5g
y=16.1g
z=9.8g
根据已知条件列出参加反应的锌质量(x)的比例式![]() =
=![]() ;
;
该黄铜样品中铜的质量分数为![]() ×100%=74%;
×100%=74%;
若要使所得滤液中溶质的质量分数为10%,则需加入水的质量为![]() -(6.5g+100g-0.2g)=54.7g;
-(6.5g+100g-0.2g)=54.7g;
若用98%的浓硫酸配制所用的稀硫酸,则需要浓硫酸的质量为![]() =10g;
=10g;
(6)若工业上用含Cu2S 80%的辉铜矿111t(炼制过程中辉铜矿的损失率为20%),根据铜元素守恒,可得能炼出能炼出上述黄铜的质量为111t×80%×![]() ×(1-20%)÷74%=76.8t。
×(1-20%)÷74%=76.8t。
故答案为:
(1)Zn+H2SO4=ZnSO4+H2↑;
(2)![]() =
=![]() ;
;
(3)74%;
(4)54.7g;
(5)10g;
(6)76.8t。

 阅读快车系列答案
阅读快车系列答案【题目】小华同学围绕“铁在氧气中燃烧”的实验展开以下探究活动。
(1)写出铁丝在氧气中燃烧的文字或符号表达式_____,该反应属于_____(填基本反应类型)
①实验前将铁丝绕成螺旋状的目的是_____
②确保实验成功还要做到_____(写一点);
(2)(实验探究)探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系
实验 | 现象 | 解释与结论 |
实验1:取直径0.20mm、含碳0.1%的铁丝在氧气中燃烧 | 零星的火星四射 | 0.20mm的铁丝,在氧气中燃烧“火星四射”与其含碳量的关系为_____ |
实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
实验3:取_____的铁丝,在氧气中燃烧 | _____ |
(拓展延伸)他认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验,若用排水法收集一瓶体积分数为90%的氧气,因为氧气约占空气体积的_____,所以应预先向容积为400ml的集气瓶中加入水的体积为_____ml。