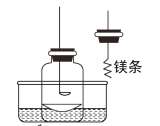
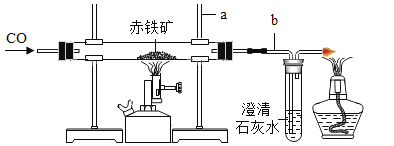
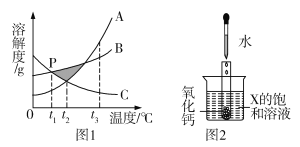
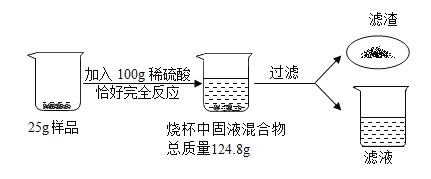
题目内容
【题目】t℃时,有100g质量分数为5%的KNO3溶液,若想将其质量分数变为10%,可采用的方法是( )
A.等温蒸发掉溶剂的![]() B.将原溶液与100g溶质质量分数为25%的KNO3溶液相混合
B.将原溶液与100g溶质质量分数为25%的KNO3溶液相混合
C.等温蒸发掉50g水D.再加入5gKNO3
【答案】C
【解析】
100g有质量分数为5%的KNO3溶液中,溶质质量为:100g×5%=5g,溶剂质量为100g-5g=95g。
A、等温蒸发掉溶剂的![]() ,实际蒸发溶剂质量为
,实际蒸发溶剂质量为![]() ,此时溶质质量分数为=
,此时溶质质量分数为=![]() ;故选项错误;
;故选项错误;
B、100g溶质质量分数为25%的KNO3溶液中溶质质量为100g×25%=25g,混合后溶质质量分数=![]() ;故选项错误;
;故选项错误;
C、 等温蒸发掉50g水后溶质质量分数=![]() ;故选项正确;
;故选项正确;
D、再加入5gKNO3后溶质质量分数=![]() ;故选项错误。
;故选项错误。
故选:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小红想研究影响过氧化氢(H2O2)分解速度的因素。在四支试管中分别加入0.2g二氧化锰粉末,然后加入等量的不同溶质质量分数(浓度)的过氧化氢溶液,观察气泡产生的速度,记录如下:
实验次数 | 1 | 2 | 3 | 4 |
H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
MnO2质量 | 0.2g | 0.2g | 0.2g | 0.2g |
气泡产生的速度 | + | ++ | +++ | ++++ |
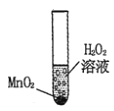
(1)该实验研究的问题是:过氧化氢分解的速度与___________的关系。
(2)为了检验产生的气体是否为氧气,请你写出检验的方法____________________。
(3)实验完毕,可利用过滤法回收剩余溶液中的二氧化锰粉末。在过滤过程中,下列仪器不需要的有_______。要完成该实验还缺少的一种玻璃仪器的名称为___________。
A 玻璃棒 B 酒精灯 C 铁架台 D 烧杯
【题目】以下是某同学在学习质量守恒定律时记的学习笔记,请你帮他一起整理完成:
(1)在化学变化中,下列说法正确的是(______)
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A ①②
B ①③
C ③④
D ②④
(2)某纯净物X燃烧的化学方程式为:![]() ,则X的化学式是(______)
,则X的化学式是(______)
A CH2O B C2H4 C CH4O D CH4
(3)在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生反应,一段时间后,测得有关数据如下表,则关于此反应,认识不正确的是(______)
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 20 | 3 | 2 | 20 |
反应后质量/g | x | 28 | 2 | 0 |
A 该反应的基本化学反应类型为化合反应
B 反应后甲物质的质量值x=15
C 此反应中乙物质和丁物质的质量比为5:4
D 物质丙一定是反应的催化剂
(4)3.0g某纯净物完全燃烧后生成4.4g二氧化碳和1.8g水,则对该物质相关判断正确的是(______)
A 该物质只含碳、氢元素
B 该物质一定含有碳、氢元素,可能含有氧元素
C 该物质由碳、氢、氧元素组成
D 该物质分子中碳原子和氢原子的个数比为1:2
(5)如图为某化学反应的微观模拟示意图,下列有关该反应的说法中,正确的是(______)
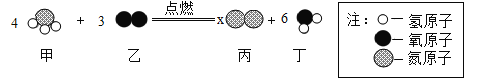
A 四示中x的值为4
B 该反应中甲丁是化合物,乙丙是单质
C 参加反应的甲、乙两物质的质量比为17:24
D 反应前后氮元素的化合价没有发生改变