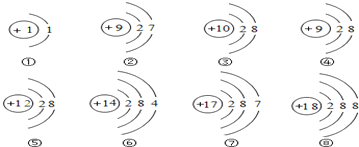
题目内容
【题目】用NaOH固体配置200g10%的NaOH溶液,下列装置或操作正确的是
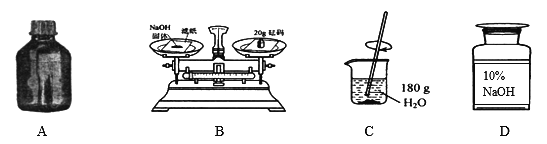
A. NaOH的固体保存 B. 用天平称取NaOH固体
C. 加水溶解氢氧化钠固体 D. 将配好的溶液装瓶存放
【答案】C
【解析】A、氢氧化钠固体应保存在广口瓶中,图中试剂瓶是细口瓶,图中所示操作错误;
B、托盘天平的使用要遵循“左物右码”的原则,且氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,图中所示操作错误;
C、用NaOH固体配制200g10%的NaOH溶液,溶质质量=溶液质量×溶质的质量分数,配制200g10%的NaOH溶液,需氢氧化钠的质量=200g×10%=20g;溶剂质量=溶液质量-溶质质量,则所需水的质量=200g-20g=180g;溶解时,在烧杯中进行,用玻璃棒进行搅拌,图中所示操作正确;
D、配制好的氢氧化钠溶液应保存在细口瓶中,图中试剂瓶是广口瓶,图中所示操作错误。

【题目】在学习盐酸的化学性质时,甲、乙两位同学分别做了稀盐酸和碳酸钠溶液反应的实验(如图1)。
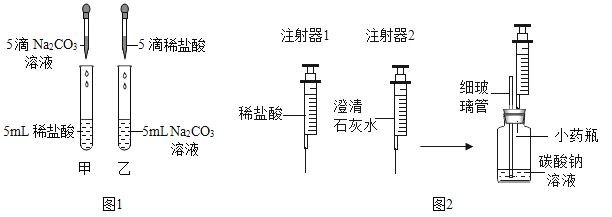
(实验现象)甲同学的实验中溶液有气泡冒出,乙同学的实验中溶液无气泡冒出。
(1)写出甲同学实验的化学反应方程式:_____________。
(提出问题)乙同学的实验中溶液为什么没有气泡冒出?
(查阅资料)碳酸钠和稀盐酸反应不仅可以生成二氧化碳还可以生成碳酸氢钠
(实验)同学们设计并进行了如图2所示的实验(装置气密性良好)。
实验编号 | 实验步骤 | 实验现象 |
① | Ⅰ.用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
② | Ⅰ.用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水变浑浊 |
(2)细玻璃管在实验中的主要作用是________;实验①中细玻璃管中液柱略微升高的原因___________。
(3)实验②中Ⅰ的现象是_________;实验①、②中步骤Ⅱ:注射器2必须缓慢地从瓶中抽取气体的原因是_________________。
(实验反思)此反应说明反应物的量不同,产物可能不同,试另举一例:____________。
(若正确回答下列问题加4分,总分不超过60分)
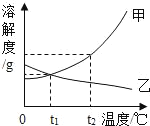
在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与稀盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:
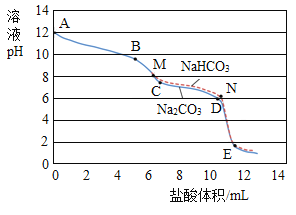
图中各线段实验现象如下表:
溶液 | 线段 | 实验现象 |
Na2CO3 | AB | 无气泡 |
BC | 有少量气泡 | |
CD | 有大量气泡 | |
DE | 几乎无气泡 | |
NaHCO3 | MN | 立即有大量气泡 |
NE | 几乎无气泡 |
(4)在AB段,溶液中的溶质有_________。
(5)分析图表,体现碳酸钠与稀盐酸反应分两步:
第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应的化学方程式为:__________。
【题目】鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,小军同学进行了如下实验:
将鸡蛋壳洗净、干燥并捣碎后,与足量稀盐酸在烧杯中反应(假设鸡蛋壳中杂质不与稀盐酸反应)。
有关实验数据如表:
反应前 | 反应后 | ||
实验 数据 | 稀盐酸的质量 | 鸡蛋壳的质量 | 剩余物的质量 |
100g | 12g | 108.7g | |
(1)根据质量守恒定律可知,反应中产生二氧化碳气体______g。
(2)计算该鸡蛋壳中碳酸钙的质量_____。