题目内容
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的应用
(1)下列铁制品的利用与金属导热性有关的是________________(填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的________________。
Ⅱ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能_____________________;
Ⅲ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
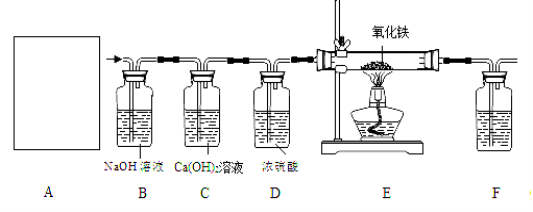
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
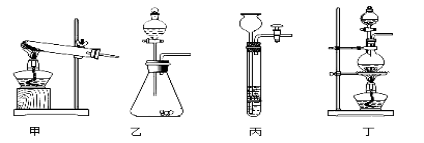
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
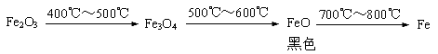
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。
【答案】I.铁的应用
(1)B (2)氧气和水(或O2和H2O)
II铁的冶炼
(1)Fe2O3+3CO![]() 2Fe+3CO2 ;(2)提供热源,维持炉温
2Fe+3CO2 ;(2)提供热源,维持炉温
Ⅲ实验探究炼铁原理
(1)丁;(2)证明CO2是否已经除尽;吸收水分(或干燥CO)
(3)澄清的石灰水(或氢氧化钙溶液);CO2+Ca(OH)2═CaCO3↓+H2O;
(4)缺少尾气处理装置
(5)FeO Fe3O4和FeO
(6)4.80;Fe3O4; CO+3Fe2O3![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
试题分析:I.铁的应用
(1)分析所给三种金属制品可以知道,铁锅是利用了金属的导热性.
(2)铁吸收水与氧气后会变成铁锈,所以“双吸剂”它能够吸收空气中的水分和氧气.
II铁的冶炼
(1)赤铁矿的主要成分是氧化铁,氧化铁和一氧化碳反应能生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2 .
2Fe+3CO2 .
(2)炼铁时要用到焦炭,它有两个作用.炼铁时需要高温,焦炭与氧气反应生成二氧化碳,同时放出大量热,可供给炼铁使用;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳;
Ⅲ实验探究炼铁原理
(1)草酸(H2C2O4)与浓硫酸混合加热会产生一氧化碳,反应物均为液体,且需要加热,所以选择发生装置丁;
(2)装置C证明CO2是否已经除尽;浓硫酸具有吸水性,常用来干燥气体;
(3)澄清的石灰水可以用来验证二氧化碳气体;方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(4)一氧化碳有毒,不能直接排放.缺少尾气处理装置;
(5)加入足量的稀盐酸,发现固体全部溶解,但无气泡产生,说明没有铁生成,这样就是Fe3O4和FeO的组合了,黑色粉末可能是:①Fe3O4;②FeO③Fe3O4和FeO.
(6)纯净的Fe2O3固体质量为:33.00g﹣28.20g=4.80g,其中铁元素的质量为4.80g×![]() =3.36g,氧元素的质量为4.80g﹣3.36g=1.44g;反应后损失的氧元素的质量为33.00g﹣32.84g=0.16g,所以设反应后黑色固体FexOy,则铁元素:氧元素=56x:16y=3.36g:(1.44g﹣0.16g);解得x:y=3:4
=3.36g,氧元素的质量为4.80g﹣3.36g=1.44g;反应后损失的氧元素的质量为33.00g﹣32.84g=0.16g,所以设反应后黑色固体FexOy,则铁元素:氧元素=56x:16y=3.36g:(1.44g﹣0.16g);解得x:y=3:4
故反应后黑色固体是Fe3O4,Fe2O3与CO反应生成Fe3O4和CO,方程式为:CO+3Fe2O3![]() 2Fe3O4+CO2
2Fe3O4+CO2