题目内容
(2011?东城区二模)为探究四瓶未知无色溶液的成分,甲、乙、丙三组同学分别设计了如下实验.已知四种溶液分别是Na2CO3,NaOH、Ca(OH)2和稀盐酸中的一种.实验过程
甲组实验方案:将四瓶溶液标号分别为1,2,3,4,只利用紫色石蕊溶液进行实验.
| 实验步骤和操作 | 实验现象和结论 |
(1)如图所示: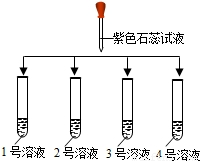 | ①2号溶液由无色变为红色, 则2号溶液是______ ②另三支试管中溶液均由无色变蓝色 |
(2)另取1、3、4号溶液,分别滴加2号溶液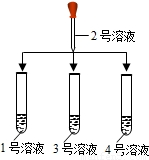 | ①3号溶液中有气泡放出, 则3号溶液是______ ②另外二支试管中溶液无明显变化 |
| (3)另取1,4号溶液,分别滴加______ | ①1号溶液中有白色沉淀析出, 则反应的化学方程式为______ ②另一支试管中溶液中无明显变化 |
| 实验操作 | 实验现象 | 实验结论 |
任取三种溶液于三支试管中,分别滴加第四种溶液 | ①一支试管中有气泡放出 其余二支试管中溶液无明显变化 | ①第四种溶液为稀盐酸 |
| ②一支试管中有白色沉淀析出, 其余二支试管中溶液无明显变化 | ②第四种为Na2CO3溶液 | |
| ③三支试管中溶液均无明显变化 | ③第四种为NaOH溶液 |
经过交流后,发现实验结论______(填序号)是不正确的;若该结论作正确,对应的实验现象应是______.
丙组实验方案:将四种溶液编号为1,2,3,4,不用其他试剂进行实验.
| 实验操作 | 实验现象 | 实验结论 |
如图所示: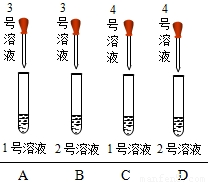 | ①A,B,C均无明显变化 ②D中有沉淀析出 | 标号为1,2,3,4的溶液依次为(用化学式表示): ______或______ |
【答案】分析:甲组实验方案:
根据酸碱指示剂在酸碱中的显色进行分析;
根据碳酸盐和酸反应会生成二氧化碳气体进行分析;
根据碳酸根离子会与钙离子反应生成碳酸钙沉淀进行分析;
乙组实验:根据碳酸钠和其余三种物质反应的现象进行分析;
丙组实验:根据碳酸钠和氢氧化钙反应会生成碳酸钙沉淀进行分析.
解答:解:甲组实验:
(1)石蕊遇酸显红色,所以2号就是酸性溶液,故答案为:稀盐酸;
(2)盐酸和碳酸盐反应会生成二氧化碳气体,所以3号就是碳酸钠溶液,故答案为:碳酸钠溶液;
(3)氢氧化钠和氢氧化钙中的阳离子不同,可以通过鉴别阳离子鉴别两者,碳酸钠和氢氧化钙会生成碳酸钙沉淀和氢氧化钠没有现象,故答案为:3号溶液 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
乙组实验:碳酸钠和盐酸反应会生成二氧化碳气体,和氢氧化钙反应会生成碳酸钙沉淀,和氢氧化钠反应没有明显现象,故答案为:②一支试管中有气泡放出、一支试管中有白色沉淀析出、一支试管中无明显现象;
丙组实验:A,B,C均无明显变化,D中有沉淀析出,所以2、4就是碳酸钠和氢氧化钙,1、3就是氢氧化钠和盐酸,故答案为:NaOH、Ca(OH)2、HCl、Na2CO3或HCl、Na2CO3、NaOH、Ca(OH)2(本题只需要将1中液体滴加到D试管中就可以确定是可能中的哪一种,若沉淀溶解就是后一顺序,沉淀不溶解就是前一顺序.现有的操作相当于没有结论,这是设计者开放设计时的不足)
点评:在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答.
根据酸碱指示剂在酸碱中的显色进行分析;
根据碳酸盐和酸反应会生成二氧化碳气体进行分析;
根据碳酸根离子会与钙离子反应生成碳酸钙沉淀进行分析;
乙组实验:根据碳酸钠和其余三种物质反应的现象进行分析;
丙组实验:根据碳酸钠和氢氧化钙反应会生成碳酸钙沉淀进行分析.
解答:解:甲组实验:
(1)石蕊遇酸显红色,所以2号就是酸性溶液,故答案为:稀盐酸;
(2)盐酸和碳酸盐反应会生成二氧化碳气体,所以3号就是碳酸钠溶液,故答案为:碳酸钠溶液;
(3)氢氧化钠和氢氧化钙中的阳离子不同,可以通过鉴别阳离子鉴别两者,碳酸钠和氢氧化钙会生成碳酸钙沉淀和氢氧化钠没有现象,故答案为:3号溶液 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
乙组实验:碳酸钠和盐酸反应会生成二氧化碳气体,和氢氧化钙反应会生成碳酸钙沉淀,和氢氧化钠反应没有明显现象,故答案为:②一支试管中有气泡放出、一支试管中有白色沉淀析出、一支试管中无明显现象;
丙组实验:A,B,C均无明显变化,D中有沉淀析出,所以2、4就是碳酸钠和氢氧化钙,1、3就是氢氧化钠和盐酸,故答案为:NaOH、Ca(OH)2、HCl、Na2CO3或HCl、Na2CO3、NaOH、Ca(OH)2(本题只需要将1中液体滴加到D试管中就可以确定是可能中的哪一种,若沉淀溶解就是后一顺序,沉淀不溶解就是前一顺序.现有的操作相当于没有结论,这是设计者开放设计时的不足)
点评:在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答.

练习册系列答案
相关题目
(2011?东城区二模)钢铁是使用最多的金属材料.
(1)下图为实验室炼铁的装置图,A中反应的化学方程式是;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是浓溶液.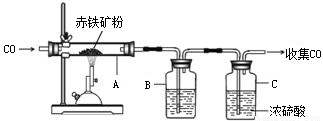
(2)工业上可用酸清洗锈蚀的金属.将生锈的铁片和生锈的铜片[铜锈的成分是Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:
①铜锈溶解:Cu2(OH)2CO3+4HCl=2CuCl2+3X+CO2↑,则X的化学式为;
②铁锈溶解:化学方程式为;
③有金属单质生成:化学方程式为.
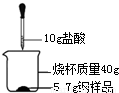
(3)某化学小组欲测定一种钢样品中铁的含量,实验操作如图所示,实验结果记录如下表:
①经计算,这种钢样品中铁的含量是% (精确到0.1%).
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻.但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是 .
(1)下图为实验室炼铁的装置图,A中反应的化学方程式是;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是浓溶液.

(2)工业上可用酸清洗锈蚀的金属.将生锈的铁片和生锈的铜片[铜锈的成分是Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:
①铜锈溶解:Cu2(OH)2CO3+4HCl=2CuCl2+3X+CO2↑,则X的化学式为;
②铁锈溶解:化学方程式为;
③有金属单质生成:化学方程式为.
(3)某化学小组欲测定一种钢样品中铁的含量,实验操作如图所示,实验结果记录如下表:
| 反应时间 | t | t1 | t2 | t3 |
| 烧杯和药品质量/g | 55.7 | 55.6 | 55.5 | 55.5 |
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻.但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是 .