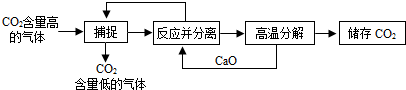
题目内容
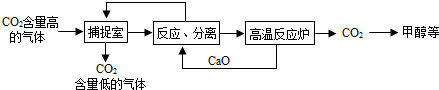
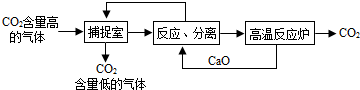
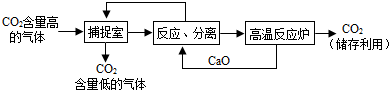
“碳捕捉技术”是指通过一定方法,将工业生产中产生的CO2分离出来进行储存和利用.常利用NaOH溶液来“捕捉”CO2,其过程如图所示(部分条件及物质未标出).
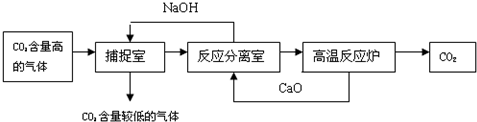

分析:根据题干提供的信息进行分析,氢氧化钠能与二氧化碳发生化学反应生成碳酸钠和水;氧化钙能与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钙高温能反应生成氧化钙和二氧化碳,据此解答.
解答:解:A、使用该方法吸收二氧化碳,能减少二氧化碳的排放,故A正确;
B、捕捉室内“捕捉”CO2采用的是氢氧化钠与二氧化碳反应的方法,属于化学方法,故B正确;
C、反应室中氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,采用过滤的方法分离,不是结晶的方法,故C错误;
D、该方法中氧化钙和氢氧化钠可以循环利用,故D正确;
故选C.
B、捕捉室内“捕捉”CO2采用的是氢氧化钠与二氧化碳反应的方法,属于化学方法,故B正确;
C、反应室中氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,采用过滤的方法分离,不是结晶的方法,故C错误;
D、该方法中氧化钙和氢氧化钠可以循环利用,故D正确;
故选C.
点评:本题考查了二氧化碳的吸收,完成此题,可以依据有关物质的性质进行.

练习册系列答案
相关题目