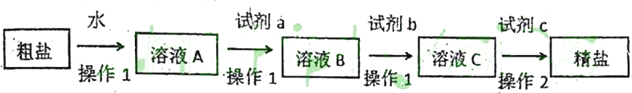
题目内容
【题目】一种不纯的铁粉,已知它含有铜、铝、镁中的一种或几种金属杂质。现取5.6g该铁粉和足量的稀硫酸反应生成0.2g氢气。则该铁粉中一定含有的金属杂质是( )
A.铜
B.铝
C.镁
D.铝、镁的混合物
【答案】A
【解析】
铝、镁与硫酸反应的化学方程式为:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑,Mg+ 2HCl = MgCl2 + H2↑,根据化学方程式可知:每54份质量的铝能生成6份质量的氢气,即每18份质量的铝能生成2份质量的氢气,每24份质量的镁能生成2份质量的氢气。
假设这5.6 g全部为铁,设生成氢气质量为x。

![]() ,x=0.2g;假设5.6g是铝或镁,则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不能反应,所以此铁块中一定含有的金属杂质是铜。故选A。
,x=0.2g;假设5.6g是铝或镁,则生成氢气质量都大于0.2g,所以必须含有产生氢气小于0.2g的金属,在这几种金属中只有铜与酸不能反应,所以此铁块中一定含有的金属杂质是铜。故选A。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
【题目】下表是某同学探究金属活动性顺序的实验报告,请你在空白处填空。
实验步骤 | 实验现象 | 反应的化学方程式 |
(1)将锌片、铜片分别投入到盛有稀H2SO4的试管中。 | _____ | _____ |
(2)将铜片投入到盛有AgNO3溶液的试管中。 | 在铜片的表面覆盖了一层银白色物质,溶液呈_____色 | _____ |
(3)结论:Zn、Cu、Ag三种金属由强到弱的活动顺序为_____。 | ||