题目内容
【题目】某粗盐样品中含有少量MgSO4和CaCl2杂质,某化学兴趣小组欲除去其中的杂质,得到纯净的NaCl晶体,设计了如下图所示的实验方案。请回答下列问题:
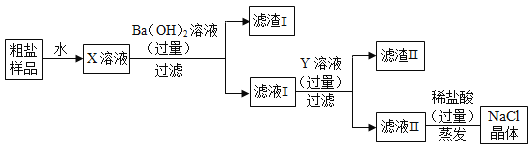
(1)写出X溶液中的杂质与Ba(OH)2溶液反应的化学方程式_____。
(2)滤液Ⅱ除氯化钠以外,还含有其他溶质成分,如何检验_____?
【答案】MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓ 取样加入足量氯化钙溶液,若有白色沉淀生成则有碳酸钠,再将反应后液体静置,取上层清液滴加酚酞溶液,溶液变红,说明含有氢氧化钠
【解析】
(1)硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁,化学方程式为:MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓;
(2)氢氧化钡能除去硫酸镁,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,氢氧化钡与碳酸钠反应生成氢氧化钠和碳酸钡,所以Y溶液是碳酸钠,滤液Ⅱ中除氯化钠以外,还含有氢氧化钠(生成的)、碳酸钠(过量的)。碳酸钠溶液呈碱性,对氢氧化钠的检验存在干扰,所以先用足量的氯化钙完全除去碳酸钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明含有氢氧化钠。检验的方法是取样加入足量氯化钙溶液,若有白色沉淀生成则有碳酸钠,再将反应后液体静置,取上层清液滴加酚酞溶液,溶液变红,说明含有氢氧化钠。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目