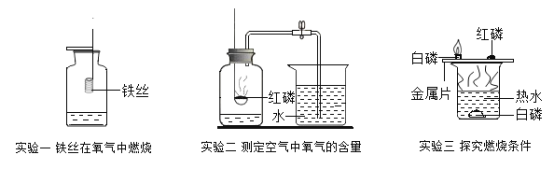
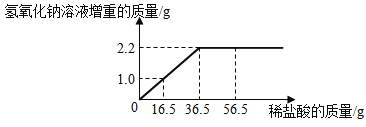
题目内容
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
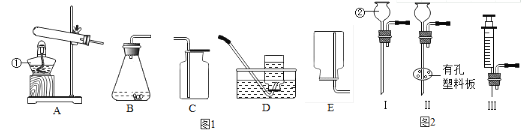
(1)写出图中带标号仪器的名称:①_____②_____。
(2)若实验室对你开放,请从图1中选择合适的装置,制取一种你熟悉的气体。你想制取的气体是_____,选择的发生装置是_____(填序号,下同),选择的收集装置是_____,选择此收集装置的理由是_____。
(3)装置B虽然操作简便,但无法控制反应速率。请从图2中选取_____(填序号)取代装置B中的单孔塞,以达到控制反应速率的目的。
(4)探究制取氧气的适宜催化剂。
实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种海藻酸钠微球,分别重复上述实验,得到右下图的锥形瓶内压强随时间变化的曲线图。
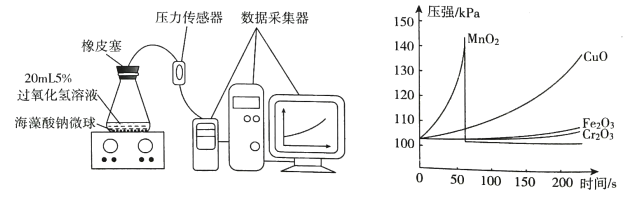
①每次实验时,海藻酸钠微球数应相同的原因是_____
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_____。
③从实验曲线看,催化效果较好、反应温和的催化剂是_____。
【答案】酒精灯 长颈漏斗 O2 A(或B) C(或D) 氧气密度比空气大(或氧气不易溶于水) Ⅲ 确保催化剂用量一致(或其他合理答案即可) 产气速率过快,导致气压过大,橡胶塞被弹出(或其他合理答案) CuO
【解析】
(1)图中①是酒精灯,②是长颈漏斗。故答案为:酒精灯、长颈漏斗;
(2)根据图1的装置。可以制取氧气,若要使用高锰酸钾或氯酸钾制取氧气,则发生装置为A,收集装置为C或D;若要使用双氧水制取氧气,则发生装置为B,收集装置为C或D。可以制取氢气,使用固体药品锌和液体药品稀硫酸制取,则发生装置B,收集装置为E或D。可以制取二氧化碳,使用固体药品大理石或石灰石和液体药品稀盐酸,则发生装置为B,收集装置为C。故答案为:氧气、A(或B)、C(或D)、氧气密度比空气大(或氧气不易溶于水)(该问答案合理即可);
(3)若要控制反应速率。若选用图2的装置Ⅰ,长颈漏斗无法控制反应速率。若选用装置Ⅱ,生成的气体直接通过右侧导管进入收集装置中,无法控制反应的速率。若选用装置Ⅲ,可以通过注射器控制反应速率。故答案为:Ⅲ;
(4)①该实验的目的是探究制取氧气的适宜的催化剂,需要做对照实验。每次实验时,海藻酸钠微球数应相同是为了确保催化剂用量一致。故答案为:确保催化剂用量一致(或其他合理答案即可);
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,可能是因为产生气体的速率过快,导致气压过大,橡皮塞被弹出。故答案为:产气速率过快,导致气压过大,橡胶塞被弹出(或其他合理答案);
③从实验曲线看,二氧化锰太剧烈,氧化铁和三氧化二铬太慢,故催化效果较好、反应温和的催化剂是氧化铜。故答案为:CuO。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
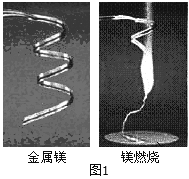
(1)根据镁燃烧发出耀眼的白光这一特点,在军事上用于制造_____;
(2)同学们通过称量发现:即使不考虑参加反应的氧气的质量,在石棉网上收集到产物的质量也小于烧掉镁条的质量,看似该反应不遵循质量守恒定律。请你分析出现这种结果的原因可能是:_____;
(3)小红按图2装置进行实验,结果符合质量守恒定律,同时还发现产物中有少量黄色固体。决定探究黄色固体为何物。
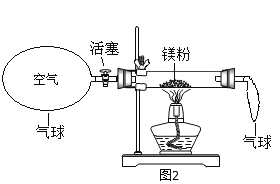
(提出问题)黄色固体是什么?
(查阅资料)得到如下信息①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体:③氮化镁可与水剧烈反应产生氨气;④氨气有刺激性气味,能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体可能是Mg3N2;
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象 | 结论 |
_____ | _____ | 黄色固体是Mg3N2 |
(反思交流)
①写出镁条燃烧生成氮化镁的化学方程式为_____;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。
③氢气也可以在氯气中能够燃烧,反应方程式为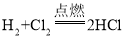 。结合以上事实,请你谈一谈对燃烧的新认识_____。
。结合以上事实,请你谈一谈对燃烧的新认识_____。