题目内容
【题目】MgSO4和Na2SO4的浴解度表及溶解度曲线如图。下列说法正确的是 ( )
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度 S/g | MgSO4 | 33.7 | 38.9 | 44.5 | 50.6 | 54.6 | 55.8 |
Na2SO4 | 19.5 | 40.8 | 48.8 | 47.5 | 45.3 | 44.8 | |
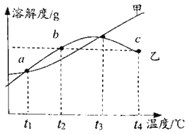
A. 甲为Na2SO4
B. 应介于40℃-50℃之间
C. 乙的饱和溶液,降温到的过程中,一直有晶体析出
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
【答案】BD
【解析】
A、甲为MgSO4,乙为Na2SO4;故选项错误;
B、t3℃应介于40℃~50℃之间正确,故选项正确;
C、t4℃乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出,开始没有晶体析出;故选项错误;
D、b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数正确,故选项正确;
故选:BD。

 阅读快车系列答案
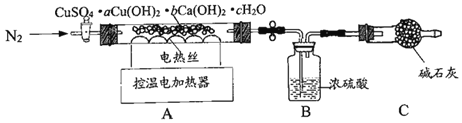
阅读快车系列答案【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下图所示:
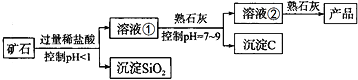
资料信息:部分金属阳离子以氢氧化物形成沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
根据以上信息进行分析,下列说法中错误的是
A. 加入稀盐酸时一定发生了复分解反应B. 沉淀C一定属于混合物
C. 上图所示制备氢氧化镁的流程中三次用到了过滤操作D. 溶液②中的溶质最多为2种
【题目】萱萱同学在实验室发现了一瓶久置的标签残缺的无色溶液(如图甲所示),为确认中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)同学们在跟实验员老师了解了情况以后,猜想其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(查阅资料)上述四种物质的相关信息如下:
物 质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
(探究实验)
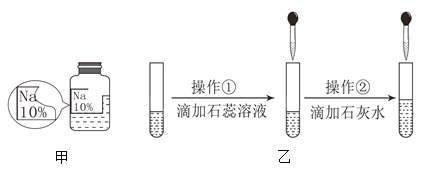
(1)通过查阅资料,他认为可以排除________________,依据是______________________。
(2)他又做了如图乙所示实验继续探究,在进行操作①后可确定溶质不是NaCl,则其实验现象是________________________。
(3)在进行操作②时有白色沉淀产生,由此又可以排除猜想中的_______________,产生沉淀的反应的化学方程式是_______________________。(探究结论)该同学经过分析后认为标签也可能是“NaOH”,他的理由是_____________。另有同学猜想其中的溶质还可能是NaNO3,但萱萱同学通过对实验现象的分析否定了这种猜想,她的理由是___________________________________________________。
【题目】如表格是甲乙丙三种物质在不同温度下的溶解度(单位g),如图是KNO3、NaCl两种固体的溶解度曲线,请结合表格和曲线回答下列问题
0℃ | 30℃ | 60℃ | 90℃ | |
甲 | 13.3 | 45.8 | 110 | 202 |
乙 | 35.5 | 36.0 | 37.1 | 38.1 |
丙 | 0.18 | 0.16 | 0.12 | 0.08 |
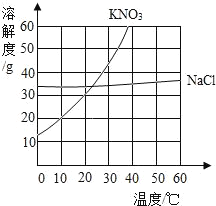
(1)甲、乙、丙三种物质中可能是硝酸钾的是_____;
(2)欲使30℃时丙的饱和溶液转化为不饱和溶液,除加溶剂外还可以采取的方法是_____;
(3)在30℃时,将50g甲放入100g水中,充分搅拌。所得溶液的质量约为_____g,将此混合物升温到90℃时,以下说法正确的是_____
A 甲的溶解度变大 B 甲溶液的质量变大 C 溶液中甲的质量分数不变
(4)KNO3中混有少量NaCl,提纯KNO3采取_____结晶方法。
【题目】钙片的标签如图所示,且钙片中只有碳酸钙中含有钙元素。为测定其真实的含钙量,小东取10片钙片放入盛足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量。
小东做了三次实验,数据如下表:
物质的质量/ g | 第一次 | 第二次 | 第三次 | 平均值 |
反应前:烧杯+盐酸 | 22 | 22 | 22 | 22 |
10片钙片 | 8 | 8 | 8 | 8 |
反应后:烧杯+剩余物 | 26.7 | 26.5 | 26.9 | 26.7 |
(1)请列式计算每片此钙片含碳酸钙的质量_______。
(2)请通过计算说明此标签中的含钙量是否合理_______。