题目内容
质量守恒定律的定量研究对化学科学的发展具有重大意义.

(1)甲、乙、丙三个小组的同学按照如图1所示的实验探究质量守恒定律.实验中,三个小组的同学得到下列数据,其中不合理的数据是 (填组别),不合理的理由是 .
(2)如图2为某化学反应的微观示意图:
①反应中,以下叙述正确的是 .
A.原子的种类没有改变
B.原子的个数没有改变
C.分子的个数没有改变
②该反应的化学方程式为 .
(3)在化学反应A+B═C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD,则参加反应的A与B的质量比为 .

(1)甲、乙、丙三个小组的同学按照如图1所示的实验探究质量守恒定律.实验中,三个小组的同学得到下列数据,其中不合理的数据是
| 反应前后质量组别 | 甲组 | 乙组 | 丙组 |
| 盐酸与碳酸钠粉末反应前称量(g) | 85.3 | 82.8 | 86.5 |
| 盐酸与碳酸钠粉末反应后称量(g) | 85.3 | 80.6 | 87.8 |
①反应中,以下叙述正确的是
A.原子的种类没有改变
B.原子的个数没有改变
C.分子的个数没有改变
②该反应的化学方程式为
(3)在化学反应A+B═C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD,则参加反应的A与B的质量比为
分析:(1)实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应后质量会减轻;
(2)根据微观模拟图,结合图例的说明,判断反应中各物质的组成与结构,并根据判断结果写出物质的化学方程式;
(3)由题意“在化学反应A+B=C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD”,根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,可知参加反应的A与B的质量比.
(2)根据微观模拟图,结合图例的说明,判断反应中各物质的组成与结构,并根据判断结果写出物质的化学方程式;
(3)由题意“在化学反应A+B=C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD”,根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,可知参加反应的A与B的质量比.
解答:解:(1)碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠,由于实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应后质量会减轻,而甲组数据不变,丙组数据增加,故这两组数据有问题.
(2)①根据质量守恒定律,反应前后元素种类不变,原子种类和个数都不变,原子质量也不变,而分子的数目可能改变,故选AB;
②反应的微观模拟示意图中,反应物是H2O分子和C原子;生成物是CO分子和H2分子;反应为高温条件下,单质碳和水蒸气发生反应生成一氧化碳和氢气,化学方程式为H2O+C
CO+H2;
(3)已知在化学反应A+B=C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD;根据质量守恒定律可知:12g+B=28g+2g,则B=18g,因此参加反应的A与B的质量比为12g:18g=2:3.
故答案为:(1)甲组、丙组;实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应后质量会减轻,而甲组数据不变,丙组数据增加,故这两组数据有问题;(2)①AB;②H2O+C
CO+H2;(3)2:3.
(2)①根据质量守恒定律,反应前后元素种类不变,原子种类和个数都不变,原子质量也不变,而分子的数目可能改变,故选AB;
②反应的微观模拟示意图中,反应物是H2O分子和C原子;生成物是CO分子和H2分子;反应为高温条件下,单质碳和水蒸气发生反应生成一氧化碳和氢气,化学方程式为H2O+C
| ||
(3)已知在化学反应A+B=C+D中,若12gA与一定量的B恰好完全反应,生成28gC和2gD;根据质量守恒定律可知:12g+B=28g+2g,则B=18g,因此参加反应的A与B的质量比为12g:18g=2:3.
故答案为:(1)甲组、丙组;实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应后质量会减轻,而甲组数据不变,丙组数据增加,故这两组数据有问题;(2)①AB;②H2O+C
| ||
点评:对于质量守恒定律的理解要注意时所用的物质的质量包括气体、固体和液体,而气体容易被忽略,所以在设计验证质量守恒的实验时要考虑实验是否需要在密闭容器中进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: 由“
由“ ”聚集成的物质
”聚集成的物质 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: ”聚集成的物质
”聚集成的物质 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: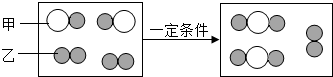
 ”聚集成的物质
”聚集成的物质