题目内容
(2012?红桥区二模)质量守恒定律的定量 研究对化学科学发展具有重大意义.
(1)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为
(2)如图为某化学反应的微观模拟图,“ ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: 由“
由“ ”聚集成的物质
”聚集成的物质
(1)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(2)如图为某化学反应的微观模拟图,“
 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: 由“
由“ ”聚集成的物质
”聚集成的物质可能
可能
(填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为1:2
1:2
,此反应的基本反应类型为化合反应
化合反应
.分析:(1)根据氢氧化钠的性质及二氧化硅的类别分析生成物,写出反应的方程式;
(2)根据分子的构成分析物质的类别,根据质量守恒分析参加反应两种反应物的分子个数比,根据反应的特点分析反应的类型
(2)根据分子的构成分析物质的类别,根据质量守恒分析参加反应两种反应物的分子个数比,根据反应的特点分析反应的类型
解答:解:(1)氢氧化钠与二氧化硅反应生成了硅酸钠和水,反应的方程式是:SiO2+2NaOH=Na2SiO3+H2O;
(2)由化学反应的微观模拟图得出各物质的微粒关系图为: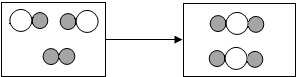
由“ ”的分子的构成可知,由
”的分子的构成可知,由 聚集成的物质是由两种元素组成的物质,如果有一种元素是氧元素,就属于氧化物.由质量守恒定律可知,反应前后原子的种类及数目不变,则参加反应的两种反应物的分子个数比为:1:2,由化学反应的微观模拟图可知,该反应是两种物质生成了一种物质,属于化合反应,.
聚集成的物质是由两种元素组成的物质,如果有一种元素是氧元素,就属于氧化物.由质量守恒定律可知,反应前后原子的种类及数目不变,则参加反应的两种反应物的分子个数比为:1:2,由化学反应的微观模拟图可知,该反应是两种物质生成了一种物质,属于化合反应,.
故答为(1)SiO2+2NaOH=Na2SiO3+H2O;(2)可能,1:2,化合反应.
(2)由化学反应的微观模拟图得出各物质的微粒关系图为:

由“
 ”的分子的构成可知,由
”的分子的构成可知,由 聚集成的物质是由两种元素组成的物质,如果有一种元素是氧元素,就属于氧化物.由质量守恒定律可知,反应前后原子的种类及数目不变,则参加反应的两种反应物的分子个数比为:1:2,由化学反应的微观模拟图可知,该反应是两种物质生成了一种物质,属于化合反应,.
聚集成的物质是由两种元素组成的物质,如果有一种元素是氧元素,就属于氧化物.由质量守恒定律可知,反应前后原子的种类及数目不变,则参加反应的两种反应物的分子个数比为:1:2,由化学反应的微观模拟图可知,该反应是两种物质生成了一种物质,属于化合反应,.故答为(1)SiO2+2NaOH=Na2SiO3+H2O;(2)可能,1:2,化合反应.
点评:本题主要考查了质量守恒定律,会利用质量守恒定律分析物质的组成、化学式等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
