��Ŀ����
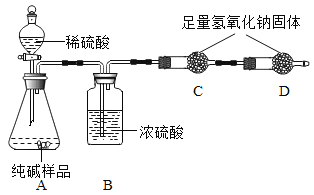
����Ŀ����һƿ�ޱ�ǩ����ɫҺ�壬Ϊ��̽�����Ǻ������ʣ�������ʵ�飺�Ѵ�Һ����ΪA������AҺ�壬����������B��������A�м����ɫ��ĩC�������ڳ����¾���Ѹ�ٲ�������B��ͬʱ�����˳�����ΪҺ��Ĵ�����D����C�������ͻ�ѧ�����ڷ�Ӧǰ��û�иı䡣��B�ռ��������ô����ǵ�ľ������ʢB�ļ���ƿ�У�ľ������ȼ�ա���ѻ�ɫ��ĩE��ȼ�����ʢB�ļ���ƿ�У��ܾ���ȼ�գ�����һ����ɫ�д̼�����ζ������F��
(1)����ʵ�飬����A��B��C��D��E��F�ֱ���ʲô���ʡ�д�������ʵ����ƻ���ţ�
A_____ ��C _____ ��D_____ ��F _____ ��
(2)�ں�����д��������������Ӧ�ı���ʽ���ѻ�����Ӧ���ͣ����ϡ��ֽ⣩д�������ڡ�
____________________��__________����
____________________��__________����
____________________��__________����
���𰸡��������� �������� ˮ �������� ��������![]() ˮ+���� �ֽⷴӦ ��������
ˮ+���� �ֽⷴӦ ��������![]() ˮ+���� �ֽⷴӦ ��+����
ˮ+���� �ֽⷴӦ ��+����![]() �������� ���Ϸ�Ӧ
�������� ���Ϸ�Ӧ
��������
�����������ȷֽ�����ˮ���������ڶ������̴������·ֽ�����ˮ��������������ʹ�����ǵ�ľ����ȼ��
����������ȼ�����ɶ����������A��B��C��D��E��F�ֱ��ǹ������⡢�������������̡�ˮ����Ͷ�������
��1��A�ǹ������⣬��H2O2��C�Ƕ������̣���MnO2��D��ˮ����H2O��F�Ƕ�������SO2��
����������⣬��H2O2����������O2���������̣���MnO2��ˮ����H2O����S����������SO2��
��2�������������ȷֽ�����ֱ���ʽ����ѧ����ʽΪ����������![]() ˮ+���������ڷֽⷴӦ��
ˮ+���������ڷֽⷴӦ��
���������ڶ������̴������·ֽ�����ֱ���ʽΪ����������![]() ˮ+�������÷�Ӧ���ϷֽⷴӦһ�������������ڷֽⷴӦ��
ˮ+�������÷�Ӧ���ϷֽⷴӦһ�������������ڷֽⷴӦ��
����������ȼ�յ����ֱ���ʽΪ����+����![]() �������÷�Ӧ���ϻ��Ϸ�Ӧ���һ�����������ڻ��Ϸ�Ӧ��
�������÷�Ӧ���ϻ��Ϸ�Ӧ���һ�����������ڻ��Ϸ�Ӧ��

 ͬ����ϰǿ����չϵ�д�
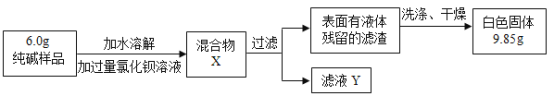
ͬ����ϰǿ����չϵ�д�����Ŀ����һ�����ı���(C3H8O)����������һ����յ���������ȼ����÷�Ӧǰ������ʵ��������±���
���� | ���� | ���� | ˮ | ������̼ | X |
��Ӧǰ����/g | 6.0 | 12.8 | 0 | 0 | 0 |
��Ӧ������/g | 0 | 0 | 7.2 | 8.8 | a |
�����ж���ȷ���ǣ�������
A. X��һ����̼B. Xһ���Ǹ÷�Ӧ�Ĵ���
C. X���ܺ�����Ԫ��D. ����a��ֵΪ2g
����Ŀ���˽̰��¿α껯ѧ�̲ľ��꼶�ϲ� ���ֽ���������������ķ�Ӧ�ж������̵Ĵ����������Լ���Ѱ���µĴ������о���ʵ�飬�����˻�ѧ̽��С�����Ȥ��
��������⣩�������ܷ�������������Һ�ֽ�Ĵ���������ܣ����Ч�����?
��ʵ��̽����
ʵ�鲽�� | ʵ������ |
I.�ֱ���ȡ5mL5%����������Һ����A��B��֧�Թ��У���A�Թ��м���ag��������ĩ�����ֱ���A��B��֧�Թ��в��������ľ�����۲����� | A�Թ��в������ݣ�������ľ����ȼ��B�Թ������������� |
II.��A�Թ���û��������ʱ�����¼������������Һ�����Ѵ����ǵ�ľ�������Թܣ���˷���������飬�۲����� | �Թ��о��������ݣ�������ľ������ȼ |
III.��ʵ��II�е�ʣ����С�Ĺ��ˣ�����������������ϴ�ӡ�������������ù���������Ϊag�� |
|
IV�ֱ���ȡ5mL5%����������Һ����C��D��֧�Թ��У���C�Թ��м���ag��������ĩ����D�Թ��м���ag�������̷�ĩ���۲����� |
|
��ʵ����ۣ�
(1)A�����������______��
(2)ʵ��II��III֤������������____��____�ڷ�Ӧǰ���û�з����仯����������������ֽ�Ĵ�����
(3)д������������������ֽ�����ֱ���ʽ____��
��ʵ�����ۣ�
(1)ʵ�����IV��Ŀ����____��
(2)��ʵ��IV�۲쵽D�Թ��в������ݵ����ʸ��죬�ɴ�����Եõ��Ľ�����____��
��ʵ����չ���������ϵ�֪������ͭ������ͭ�����Ρ���������Ҳ����������������Һ�ֽ�Ĵ����������йش�����˵������ȷ����___��
A MnO2ֻ��������������Һ�ֽ�Ĵ���
B ͬһ����ѧ��Ӧ�����ж��ִ���
C ����ֻ�ܼӿ컯ѧ��Ӧ������
D �������������ʲ�������������Ӧ�ķ�Ӧ��������