题目内容
【题目】为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取80g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 50g | 100g | m(150<m<250) | 250g |
剩余固体的质量 | 15g | 10g | 4g | 4g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的1/8于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
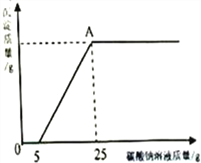
分析题中有关信息和图表(横坐标表示碳酸钠溶液、纵坐标为生成沉淀质量),回答下列问题:
(1)该石灰石样品的纯度为______.所用盐酸的溶质质量分数为__________。
(2)编号③所用稀盐酸的质量m为______g.
(3)A点处对应的溶液中溶质的质量是________?(写出计算过程)
【答案】 80% 7.3% 200克 29.25克
【解析】解:(1)该石灰石样品的纯度为![]() ×100%=80%;
×100%=80%;
50g盐酸消耗的碳酸钙质量为20g-15g=5g,设50g盐酸的溶质质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g x
![]()
x=3.65g
所用盐酸的溶质质量分数为![]() ×100%=7.3%;
×100%=7.3%;
(2)设编号③消耗碳酸钙的质量为20g-4g=16g,所用稀盐酸的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
16g y×7.3%
![]()
y=160g
碳酸钠消耗的盐酸质量为m,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
5g×10.6% m×7.3%
![]()
m=5g
所以编号③所用稀盐酸的质量m为160g+8×5g=200g;
(3)设A点处对应的溶液中溶质的质量是z
CaCl2+Na2CO3= CaCO3↓+ 2NaCl,Na2CO3+2HCl===2NaCl+H2O+CO2↑由此知道:
2NaCl ~ Na2CO3
117 106
z 25g×10.6%
![]()
y=2.925克
答:(1)该石灰石样品的纯度为80%;所用盐酸的溶质质量分数为7.3%。
(2)编号③所用稀盐酸的质量m为200g.
(3)A点处对应的溶液中溶质的质量是2.925g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某商品碳酸钙粉末包装袋上注明:碳酸钙的含量≥96%。为测定该产品中含碳酸钙的质量分数:取11.0g碳酸钙样品放入烧杯中,称得烧杯及所盛碳酸钙样品的总质量为168.0g,再把100.0g稀盐酸平均分成25.0g依次加入样品中,每次均充分反应(碳酸钙中其它成分不参加反应)。实验数据记录如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
反应后烧杯及所盛物质的总质量/g | 191.2 | 214.4 | 238.6 | 263.6 |
请你分析并计算(保留一位小数):
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g;
(2)实验过程中,所加盐酸在第_______次时碳酸钙巳经完全反应;
(3)产品中碳酸钙的质量______g;碳酸钙的质量分数______ ;该产品________ (填“合格”或“不合格”)。