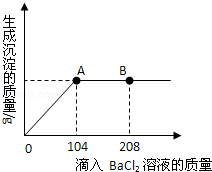
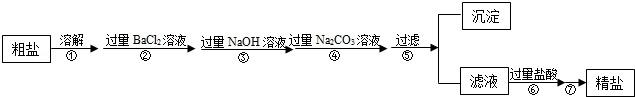
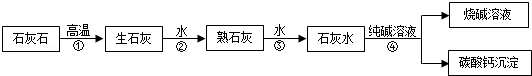
题目内容
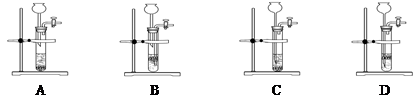
已知金属钠能与水发生如下反应:2Na+2H2O═2NaOH+H2↑,若把4.6g金属钠投入到盛有足量水的烧杯中(如图),充分反应后烧杯中剩余溶液质量是40g,请计算:
(1)生成NaOH的质量.
(2)反应后所得NaOH溶液的溶质质量分数.
(1)8g (2)20%
解析试题分析:(1)设生成的NaOH的质量为x
2Na+2H2O═2NaOH+H2↑
46 80
4.6g x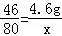 解得:x=8g
解得:x=8g
(2)反应后所得NaOH溶液的溶质质量分数为 ×100%=20%
×100%=20%
答:(1)生成NaOH的质量是8g;(2)反应后所得NaOH溶液的溶质质量分数是20%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶质质量分数的计算问题.根据化学方程式的计算,就是依据反应物和生成物间的质量比进行的;已知反应物的质量可以算出生成物的质量,反之,已知生成物的质量也可以算出所需反应物的质量.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?