题目内容
【题目】张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究。
(提出问题)Na2CO3属于________(填“酸”、“碱”、“盐”),为什么能使酚酞溶液变红?
(进行猜想)
(1)Na+使酚酞溶液变红。
(2)水分子使酚酞溶液变红。
(3)______使酚酞溶液变红。
(设计实验)
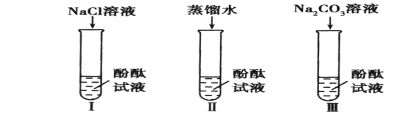
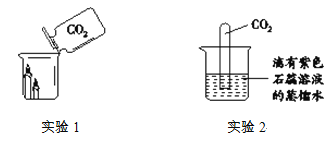
(1)实验Ⅰ的目的是为了验证猜想_________不成立。
(2)刘明同学认为实验Ⅱ没必要做,他的理由是_________。
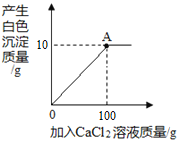
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红。向变红后的溶液中滴加CaCl2溶液至过量,振荡,出现的现象是____,反应的化学方程式是____。(提示:CaCl2溶液呈中性)
(4)由实验Ⅰ、Ⅱ、Ⅲ得出猜想(3)正确。张宁对此结论有些质疑,于是他查阅资料。
(查阅资料)Na2CO3溶液中,CO32-和H2O发生如下反应: CO32-+H2O====HCO3-+OH-
(得出结论)Na2CO3溶液中使酚酞溶液变红的粒子是_______________。
【答案】盐 略 CO32﹣ 探究Na+是否能使酚酞试液变红 酚酞试液中就有水分子(或氯化钠溶液中含有水分子) 白色沉淀 Na2CO3+CaCl2═CaCO3↓+2NaCl OH﹣.
【解析】
[提出问题]碳酸钠能电离出钠离子和碳酸根离子,所以属于盐;
[进行猜想]碳酸钠溶液中存在钠离子、碳酸根离子、水分子;
[设计实验】(1)向氯化钠溶液中加酚酞不变色,说明氯化钠溶液中的粒子都不能使酚酞变红;
(2)氯化钠溶液中含有大量水分子,在实验(1)中得到验证,所以实验(2)的探究是多余的;
(3)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀,所以现象为红色逐渐消失,产生白色沉淀;化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)我们知道只有氢氧根离子才能使酚酞变红,所以由碳酸钠溶液能使酚酞溶液变红,可以判断溶液中存在氢氧根离子。

 阅读快车系列答案
阅读快车系列答案