题目内容
【题目】实验室有一瓶长期放置的氢氧化钠固体,某兴趣小组同学欲对该固体变质情况进行探究。
Ⅰ 固体的成分分析
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】
①氢氧化钠在空气中容易变质但不会转化为NaHCO3;
②CaCl2溶液的pH=7,碳酸钠溶液的pH7
③CaCl2+Na2CO3═CaCO3↓+2NaCl
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
④碱石灰是CaO和NaOH的混合物
【提出猜想】
猜想Ⅰ:固体未变质
猜想Ⅱ:固体全部变质
猜想Ⅲ:固体部分变质
【原因分析】氢氧化钠在空气中变质的原因是___________(用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是____,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
同学 | 小红 | 小美 | 小伍 |
实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 加入过量稀硫酸 |
【实验结论】小红、小美的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都得出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小红的实验操作和现象无法确定猜想Ⅲ正确,理由是_____________________。
(二)根据小美的结论推测小伍实验现象是__________________。
Ⅱ 固体中各成分含量
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
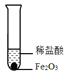
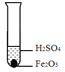
【进行实验】化学小组同学设计了如下实验装置。
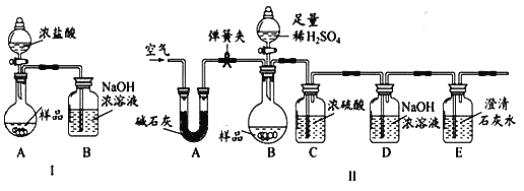
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是_______;
②小刚同学在大家讨论的基础上,设计了装置II。请分析:装置II中A的作用_______;若无装置C,对测定结果造成的影响是_______(填“偏大”、“偏小”或“无影响”);
【实验结论】称取10g样品于圆底烧瓶中,实验结束后,测得装置D增重2.2g,请你计算出样品中Na2CO3质量分数。(写出计算过程)____
【反思评价】①联想到空气中有CO2,所以实验室中的氢氧化钠应_____保存。
②若将上述5g氢氧化钠固体全部溶解在45g水中,得到的溶液中氢氧化钠质量分数_______10%(填“大于”、“小于”或“等于”)。
【答案】 CO2+2NaOH===Na2CO3+H2O 碳酸钠、氢氧化钠溶液都显碱性,都能使酚酞变红色。 因加氢氧化钙溶液引入了氢氧根离子,对氢氧化钠的检验会造成干扰 加入一定量的硫酸后,才会产生气泡,溶液由红色变为无色 浓盐酸易挥发,挥发出的氯化氢气体也被装置B吸收 吸收空气中的二氧化碳和水蒸气 偏大 53% 密封
【解析】(1).氢氧化钠在空气中变质的原因是和空气中二氧化碳反应生成碳酸钠和水;反应方程式为:CO2 + 2NaOH===Na2CO3 + H2O;(2).碱性溶液能使酚酞试液变红, 碳酸钠、氢氧化钠溶液都显碱性,都能使酚酞变红色。 (3). (一)因加氢氧化钙溶液引入了氢氧根离子,对氢氧化钠的检验会造成干扰 (二) 小美的实验中都观察到有白色沉淀生成且溶液仍是红色,说明固体是氢氧化钠和碳酸钠的混合物,加入硫酸时,硫酸先与氢氧化钠反应,氢氧化钠完全反应后,加入的硫酸再与碳酸钠反应,所以采用加硫酸的方法验证时,观察到的现象是:加入一定量的硫酸后,才会产生气泡,溶液由红色变为无色 (4). 浓盐酸易挥发,挥发出的氯化氢气体也被装置B吸收了,会导致测定结果偏大。 (5).为保证装置D只吸收反应生成的二氧化碳,装置II中A的作用吸收空气中的二氧化碳和水蒸气 (6). 若无装置C,生成二氧化碳中的水分会被D吸收,使测定结果造成的影响是偏大;装置D增重2.2g说明生成二氧化碳2.2g,设样品中Na2CO3质量为x,
Na2CO3+2HCl====2NaCl+H20+CO2↑
106 44
x 2.2g
106/x=44/2.2g x=5.3g 样品中Na2CO3质量分数=5.3g÷10g×100%=53% (7). ①实验室中的氢氧化钠应密封保存 (8). 若将上述5g氢氧化钠固体全部溶解在45g水中,因含有杂质,得到的溶液中氢氧化钠质量分数小于10%

 名校课堂系列答案
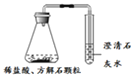
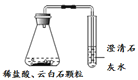
名校课堂系列答案【题目】某同学利用如下实验研究酸的性质,并进行未知物检验。
序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 红色固体消失,溶液变黄 | 固体表面有气泡产生,澄清石灰水变浑浊 | ||
(1)进行实验①、②的目的是________。
(2)依据实验③、④的现象,可得出关于方解石和云白石成分的结论是________。
【题目】同学们在实验室发现有一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分(如图)无法辨认具体是什么物质的溶液,只能看出溶质的质量分数为10%,经询问老师知道可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠溶液中的一种。为探究其成分,化学兴趣小组的同学进行如下探究,请你共同参与:

【查阅资料】小组同学查阅了相关资料,得知四种物质在常温下的溶解度如下表所示:
氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
【讨论分析】小组同学经过讨论,认为该溶液不可能是_________溶液。
【实验设计与探究】
(1)取少量样品溶液于试管中,往其中滴加酚酞试液,发现试液变红色,则该溶液不可能是_________溶液。
(2)为了进一步确定该溶液的成分,兴趣小组的同学设计以下实验方案继续进行探究,请你帮忙完善实验操作及步骤。
实验操作及步骤 | 实验现象 | 实验结论 |
取少量样品溶液于试管中,滴加氯化钙溶液 | 有白色沉淀产生 | 该溶液是碳酸钠溶液 |
取少量样品溶液于试管中,滴加_________ | 有气泡产生 |
【实验反思】
小组同学讨论后认为还可以通过往样品溶液中滴加澄清石灰水来确定该溶液的成分,请写出反应的化学方程式__________________________________。