题目内容
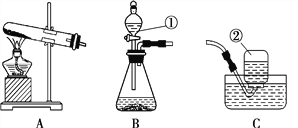
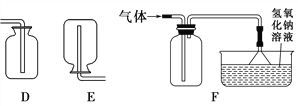
【题目】根据下列实验装置图,回答有关问题。
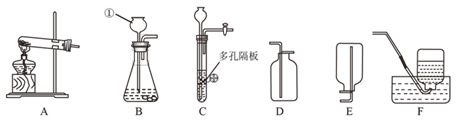
(1)图中标号仪器的名称:①_____。
(2)利用上图中 A、D 装置的组合可以制取某种气体,实验室制取该气体的化学方程式为________________。
(3)实验室制取二氧化碳的化学方程式为_______。 若用 C 装置代替 B 装置进行实验,优点为_______。
(4)实验室将 A 装置加以改动,在高温下使碳酸钙分解生成氧化钙和二氧化碳,据此反应, 试计算工业上要制取 5.6t 氧化钙,理论上需要含碳酸钙 80%的石灰石的质量是______?
【答案】 长颈漏斗 2KClO3 ![]() 2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以随时控制反应的开始和停止 12.5t
2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以随时控制反应的开始和停止 12.5t
【解析】(1)根据常见仪器解答;(2)根据反应物的状态、反应条件、生成气体的密度分析解答;(3)根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳解答;根据装置特点分析解答;(4)根据反应的化学方程式计算解答。(1)图中标号仪器的名称:①长颈漏斗;(2)A装置属于固体加热型发生装置,D 装置适合收集密度比空气大的气体,又试管口没有棉花,故该装置适合分解氯酸钾制取氧气。反应的化学方程式为2KClO3 ![]() 2KCl+3O2↑;(3)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;若用 C 装置代替 B 装置进行实验,优点为可以随时控制反应的开始和停止;(4)解:设需要石灰石的质量为 x。
2KCl+3O2↑;(3)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;若用 C 装置代替 B 装置进行实验,优点为可以随时控制反应的开始和停止;(4)解:设需要石灰石的质量为 x。
CaCO3高温CaO+CO2↑
100 56
80%x 5.6t
![]()
x=12.5t
答:需要石灰石的质量是 12.5t。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示,下列说法不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质的质量/g | 8 | 40 | 10 | 20 |
反应后物质的质量/g | 12 | 4 | X | 52 |
A. 反应中甲、乙的质量比为3:1 B. 该反应可以表示为2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
C. 该反应为分解反应 D. 丙可能为不参加反应的杂质
【题目】镁条在空气中久置表面会变黑,某小组同学设计进行实验,探究镁条变黑的条件。
(查阅资料)常温下,亚硫酸钠(Na2SO3)可与 O2 发生化合反应。
(猜想与假设)常温下,镁条变黑可能与 O2、CO2、水蒸气有关
(进行实验)通过控制与镁条接触的物质,利用下图装置(镁条长度为 3cm,试管容积为20mL),分别进行下列 5 个实验,并持续观察 20 天。
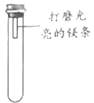
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用 NaOH 浓溶液洗涤过的空气再加入 2mL 浓硫酸 | 镁条始终无明显变化 |
2 | 加入 2mL NaOH 浓溶液 | 镁条始终无明显变化 |
3 | 先加入 2mL 浓硫酸再通入约 4mL CO2 | 镁条始终无明显变化 |
4 | 先加入 4mL 饱和 Na2SO3 溶液再充满 CO2 | 镁条始终无明显变化 |
5 | 先加入 2mL 蒸馏水再通入约 4mL CO2 | 镁条第 3 天开始变黑至第 20 天全部变黑 |
(解释与结论)
(1)实验1 和 2 中,NaOH 浓溶液的作用是_____(用化学方程式表示);
(2)实验1 的目的是_____;
(3)实验3 中,试管内的气体主要含有 CO2、_____;
(4)得出“镁条变黑一定与CO2 有关”结论,依据的两个实验是_____(填编号);
(5)由上述实验可推知,镁条变黑的条件是_____;
(反思与评价)
(6)在猜想与假设时,同学们认为镁条变黑与 N2 无关,其理由是_____;
(7)本 组 实 验 1/2 中 使 用 的 NaOH 浓 溶 液 , 而 不 是 使 用 澄 清 石 灰 水 , 理 由 是_____。