题目内容
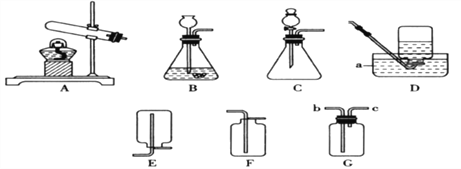
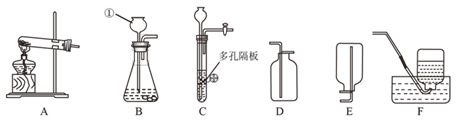
【题目】(1)下图为实验室常用的实验装置,请回答有关问题。
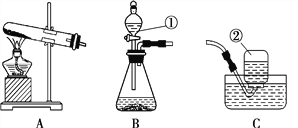
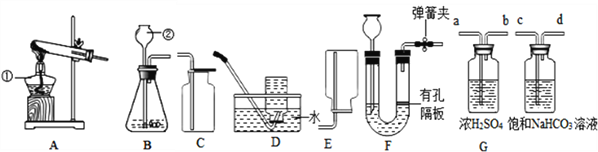
①若用A、C装置组合制取氧气,实验中,观察到水槽中气泡________(填“刚一冒出”或“连续均匀冒出”)时开始收集,一段时间收集完氧气后,将收集满氧气的瓶子______(填“倒”或“正”)放在桌面上。
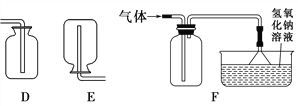
②写出用B、E装置组合制取某气体的化学反应方程式________________。
③硫化氢是有毒气体,能溶于水形成氢硫酸(其化学性质与盐酸相似)。常用块状硫化亚铁(FeS)和稀硫酸在常温发生复分解反应制H2S,某同学用F装置来收集处理H2S。实验室制H2S的化学方程式为_________________________;该装置用于收集H2S,说明其密度比空气________(填“大”或“小”)。氢氧化钠溶液的作用是_______________________________________
(2)某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性)、氢氧化钠中的一种或几种,进行如下实验:
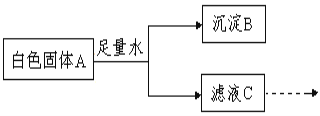
完成下列填空:根据上述实验分析,
①沉淀B的化学式为________________
②白色固A中一定含有的物质是______________(填化学式),
③C中一定含有的溶质是____________。为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作 | 现象 | 结论 |
______________ | ______________ | A中有氢氧化钠 |
【答案】 连续均匀冒出 正 H2SO4+Zn===ZnSO4+H2↑ H2SO4+FeS===FeSO4+H2S↑ 大 吸收有毒气体,防止污染环境 BaCO3 BaCl2和Na2CO3 NaCl 向滤液C中加入足量的BaCl2溶液,充分反应后,静置,取上层清液滴加无色酚酞试液 无色酚酞变红色
【解析】 (1). ①用排水法收集气体,开始出来的气体中有空气,不能立即收集,当气泡连续均匀放出时才是纯净的气体,此时开始收集。氧气的密度比空气大,收集满氧气的集气瓶正放在实验桌上。②发生装置B是固液常温型制取气体,收集装置E是向下排空气法收集气体,此气体的密度比空气的密度小,而氧气、二氧化碳的密度都比空气的密度大,故BE组合制取的气体是氢气,反应的化学方程式为:H2SO4+Zn===ZnSO4+H2↑ ③化学反应前后元素的种类不变,各种原子个数相等,故反应的化学方程式为:H2SO4+FeS===FeSO4+H2S↑ ,用F装置收集气体,气体从左端进入,空气从右端排除,说明此气体的密度比空气的密度大。氢氧化钠溶液的作用是吸收有毒气体,防止污染环境。(2)①三种物质中只有碳酸钠与氯化钡能发生反应生成白色沉淀,Na2CO3 + BaCl2==BaCO3↓+ 2NaCl,故B是BaCO3 。②白色固体A中一定含有的物质是BaCl2和Na2CO3。C中一定含有的溶质是生成的氯化钠。碳酸钠溶液、氢氧化钠溶液都能使酚酞溶液变红,所以想验证氢氧化钠是否存在,首先要将碳酸钠转化为沉淀除去,防止对氢氧化钠验证的干扰,而氯化钡溶液是中性的,故向滤液C中加入足量的BaCl2溶液,将碳酸钠完全除去,充分反应后,静置,取上层清液,滴加无色酚酞试液,酚酞溶液变红,说明氢氧化钠存在。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案