题目内容
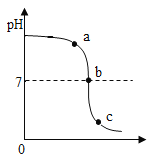
【题目】向34.2g的Ba(OH)2溶液中先后滴加质量分数为8%的CuSO4溶液和质量分数为9.8%的H2SO4溶液,绘制了滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。
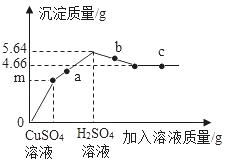
(1)a点对应溶液pH (选填“>”、“=”或“<”)7。
(2)通过计算确定加入的CuSO4溶液中的溶质质量为多少?
(3)原Ba(OH)2溶液溶质的质量分数为多少?
【答案】(1) > (2) 1.6g (3) 10%
【解析】
(1)a点后加硫酸继续生成沉淀,说明此时依然是氢氧化钡和硫酸反应,所以对应溶液pH>7。
(2)氢氧化铜能与硫酸反应生成硫酸铜和水,硫酸钡不能与硫酸反应。所以沉淀由5.64g变成4.66g是减少了氢氧化铜的质量,所以这个沉淀是硫酸铜和氢氧化钡反应生成的氢氧化铜,生成氢氧化铜的质量为:5.64g﹣4.66g=0.98g,
设加入的CuSO4溶液中的溶质质量为![]() ,
,
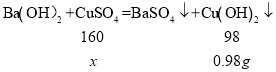
 ,解得
,解得![]() =1.6g,
=1.6g,
答:加入的CuSO4溶液中的溶质质量为1.6g;
(3)设原Ba(OH)2溶液溶质的质量分数为![]() ,
,
根据钡元素守恒可得:
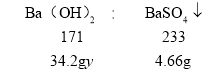
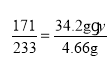 ,解得
,解得![]() =10%
=10%
答:原Ba(OH)2溶液溶质的质量分数为10%。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目