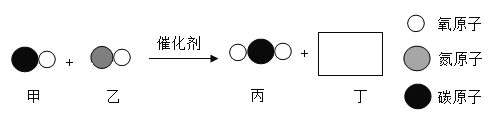
题目内容
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备绿矾(FeSO4·xH2O),工艺流程如下图所示::
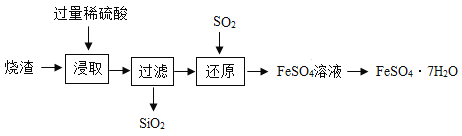
资料1: SiO2不溶于水,也不与稀硫酸反应;
资料2: +2价的铁元素容易被空气中的氧气氧化。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式为:FeO+ H2SO4= FeSO4+ H2O、_________,为提高“浸取”步骤的反应速率,除了采取“搅拌”和“使用催化剂”外,还可采取的具体措施有________(写1条)。
(2)“浸取”、“过滤”步骤后,滤液中的溶质有_________。
(3)“还原”转化的化学反应原理为:SO2+Fe2(SO4)3+2H2O=2FeSO4+2H2SO4,该步骤的主要目的是______。
(4)FeSO4溶液经过蒸发浓缩、______________、过滤、洗涤、低温干燥后得到FeSO4·xH2O晶体;低温干燥的目的是______________。
(5)以上结晶过程最好在氮气环境中进行,氮气的作用是___________。
【答案】![]() 适当增大硫酸的浓度,升高温度,将烧渣粉碎等 FeSO4、H2SO4、Fe2(SO4)3 将Fe2(SO4)3转化为FeSO4(或将Fe3+转化为Fe2+) 降温结晶 避免绿矾在干燥过程中受热分解或失去结晶水 防止绿矾在空气中被氧气氧化
适当增大硫酸的浓度,升高温度,将烧渣粉碎等 FeSO4、H2SO4、Fe2(SO4)3 将Fe2(SO4)3转化为FeSO4(或将Fe3+转化为Fe2+) 降温结晶 避免绿矾在干燥过程中受热分解或失去结晶水 防止绿矾在空气中被氧气氧化
【解析】
氧化亚铁和稀硫酸反应生成硫酸亚铁和水,氧化铁和稀硫酸反应生成硫酸铁和水。
(1)氧化铁和稀硫酸反应生成硫酸铁和水,故“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式为:![]() 、
、![]() ,增大反应物的接触面积或升高温度均可以加快反应速率,故为提高“浸取”步骤的反应速率,除了采取“搅拌”和“使用催化剂”外,还可采取的具体措施有适当增大硫酸的浓度,升高温度,将烧渣粉碎等。
,增大反应物的接触面积或升高温度均可以加快反应速率,故为提高“浸取”步骤的反应速率,除了采取“搅拌”和“使用催化剂”外,还可采取的具体措施有适当增大硫酸的浓度,升高温度,将烧渣粉碎等。
(2)浸取步骤氧化亚铁和稀硫酸反应生成硫酸亚铁和水,氧化铁和稀硫酸反应生成硫酸铁和水,二氧化硅和稀硫酸不反应,过滤掉二氧化硅,则滤液中的溶质有生成的硫酸亚铁、硫酸铁和过量的稀硫酸,故“浸取”、“过滤”步骤后,滤液中的溶质有FeSO4、H2SO4、Fe2(SO4)3。
(3)“还原”转化的化学反应原理为:![]() ,故该步骤的主要目的是将Fe2(SO4)3转化为FeSO4(或将Fe3+转化为Fe2+)。
,故该步骤的主要目的是将Fe2(SO4)3转化为FeSO4(或将Fe3+转化为Fe2+)。
(4)FeSO4溶液经过蒸发浓缩、降温结晶、过滤、洗涤、低温干燥后得到FeSO4·xH2O晶体;低温干燥的目的是避免绿矾在干燥过程中受热分解或失去结晶水。
(5)+2价的铁元素容易被空气中的氧气氧化,故以上结晶过程最好在氮气环境中进行,氮气的作用是防止绿矾在空气中被氧气氧化。

 阅读快车系列答案
阅读快车系列答案