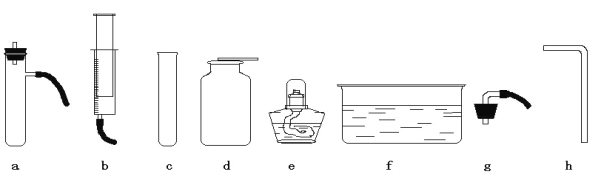
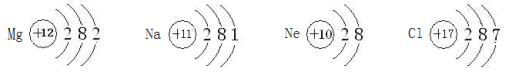题目内容
【题目】用Ba(OH)2溶液测定某种氮肥中(NH4)2SO4的质量分数(杂质溶于水,但不参加反应)。
实验如下:称取该氮肥20g加水完全溶解,向该溶液中不断滴入Ba(OH)2溶液,生成
气体及沉淀质量与加入Ba(OH)2溶液的质量关系如下所示:
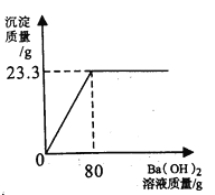
实验次序 | 1 | 2 | 3 |
滴入Ba(OH)2溶液的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 0.85 | m | 2.55 |
试分析并计算:[已知:(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑]
(1)表格中m的值为 g。
(2)实验所用氢氧化钡溶液中溶质的质量分数。
(3)该氮肥中(NH4)2SO4的质量分数。(计算结果精确至0.1%)
【答案】(1)1.70;(2)2.1%;(3)6.6%
【解析】
试题分析:(1)根据表中信息可知,20gBa(OH)2溶液与硫酸铵反应,生成氨气0.85g,到60g
Ba(OH)2溶液与硫酸铵反应,生成氨气2.55g,说明每20gBa(OH)2溶液与硫酸铵反应,能生成氨气0.85g,40gBa(OH)2溶液与硫酸铵反应,能生成氨气1.70g,故m的值为1.7g;
设所用氢氧化钡的质量为x,(NH4)2SO4的质量为y,硫酸钡沉淀的质量为2.33g
(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑
132 171 233
y x 2.33g
132:233=y:2.33g 171:233=x:2.33g
y=1.32g x=1.71g
(2)实验所用氢氧化钡溶液中溶质的质量分数
1.71g/80g×100%=2.1%
(3)该氮肥中(NH4)2SO4的质量分数
1.32g/20g×100%=6.6%

【题目】(2018天津节选)酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 | A+B | A+C | A+D | B+C |
现象 | 产生气体 | 产生沉淀 | 产生沉淀 | 产生沉淀 |
①写出溶液B、C中溶质的化学式:B_________,C________。
②写出溶液A与D反应的化学方程式__________。
【题目】下图是某钙片的说明书,请阅读解答下列问题。
X X 钙 片 主要成分:葡萄糖酸钙C6H11O72Ca 药品规格:2.5g每片含C6H11O72Ca 0.2g 用 量:每日2次,每次一片 |
①葡萄糖酸钙中含有_________种元素。
②葡萄糖酸钙中碳与钙的质量比是_______;
③按说明书服用此钙片,每天补充钙的为: 。(只写算式,不算结果)。
友情告知:C6H11O72Ca 的相对分子质量为 430
(2)现有废硫酸 4.9t。废硫酸中 H2SO4 的质量分数为20%与足量的废铁屑反应,可生产FeSO4的质量是多少?
【题目】(6分) 实验探究是科学探究的重要方法,如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题(已知铜粉在加热条件下能与氧气反应生成固体氧化铜).
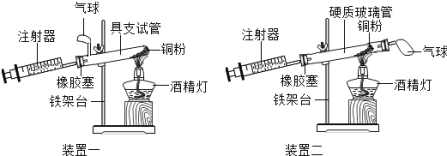
(1)根据下表提供的实验数据,完成下表.
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL |
|
(2)装置一和装置二中气球的位置不同, (填“装置一”或“装置二”)更合理,理由 是 .实验过程中,注射器如何操作? .
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两 条) 、 .