题目内容
【题目】为验证“酸的化学性质”,某班同学在实验室进行如图实验.请分析并回答相关问题:
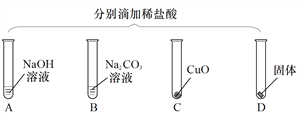
①B试管中的现象是___________,
②C中发生反应的现象是______________________________,
反应的化学方程式 _____________________________________ 。
③要全面验证酸的化学通性,D试管中能与酸反应的固体单质是______(写一种即可)。
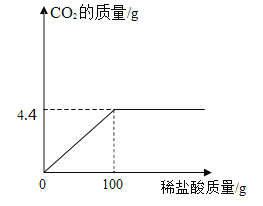
④实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有_________种(溶质不计指示剂与气体)。
【答案】 大量气泡 黑色粉末消失,无色溶液变蓝 CuO +2HCl === CuCl2+ H2O Mg 4种
【解析】(1). 碳酸钠和盐酸反应生成二氧化碳、氯化钠、水,因此会有大量气泡产生; (2).氧化铜是金属氧化物,能与盐酸反应生成氯化铜和水,氯化铜溶液是蓝色,所以观察到的现象是 黑色粉末消失,无色溶液变蓝 (3)氧化铜和盐酸的反应方程式为:CuO +2HCl === CuCl2 + H2O (4) 要全面验证酸的化学通性,D试管中能与酸反应的固体单质是活泼金属,如Mg (5). 实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有4种,分别是,和氧化铜生成的氯化铜、和氢氧化钠、碳酸钠生成的氯化钠、有与镁反应生成的氯化镁、还有过量的酸中的氯化氢。

练习册系列答案
相关题目
【题目】下列实验设计不能达到目的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 证明二氧化碳能溶于水 | 证明二氧化碳密度大于空气 | 证明通入的气体是二氧化碳 | 小苏打能与盐酸反应放出CO2 |
A. A B. B C. C D. D