题目内容
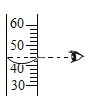
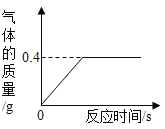
【题目】有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5 g样品加入100 g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如下图所示。试求:
(1)样品中金属铜的质量是 g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
【答案】(1)19.5;(2)19.6%
【解析】根据反应的化学方程式解答。
解:(1)由图可知,生成氢气的质量为0.4g。
设样品中锌的质量为x,消耗硫酸的质量为y。
Zn+ H2SO4 == ZnSO4 + H2↑
65 98 2
x y 0.4g
![]()
x=13g
y=19.6g
因此样品中铜的质量为32.5g-13g=19.5g
(2)所用稀硫酸的溶质质量分数![]() =19.6%。
=19.6%。
答:所用稀硫酸的溶质质量分数为19.6%。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
【题目】腾飞小组做铁与硫酸铜溶液反应的实验时,意外发现反应产生了无色无味气体,于是小组同学对此进行探究.
(提出猜想)①李欢认为该气体可能是氧气②王迎认为该气体可能是氢气③吴晶认为该气体可能是二氧化硫.李欢认为晶晶的猜想错误,理由是_____.
(进行探究)
实验操作 | 实验现象 | 结论 |
①_____ | 木条不复燃 | 李欢猜想不成立 |
②用尖嘴导管将气体导出并引燃,同 时在上方放一块干冷的玻璃片 | _____ | 王迎猜想成立 |
(反思)铁与硫酸铜溶液反应的化学方程式是_____,为什么会产生气体呢?经过小组讨论:大家一致认为肯定与_____有关.
(回归本源)该反应观察到的主要现象应该是铁表面出现红色物质,溶液由蓝色逐渐变为浅绿色,由此得到的结论是:金属活动性铁比铜_____.