题目内容
【题目】如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
⑴X中含有少量Y,应采用______的方法提纯X。
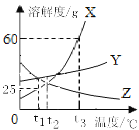
⑵t2℃时,三种物质的溶解度的大小关系是______。
⑶将t3℃时160gX的饱和溶液降温到t1℃,所得溶液的质量是______g。
⑷t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,没有析出晶体的是______。
【答案】降温结晶 Y>X=Z 125 Z
【解析】
(1)由题图可知X的溶解度受温度影响更明显,温度升高,X的溶解度增大,当X中含有少量Y,应采用降温结晶的方法提纯X,故填降温结晶;
(2)由溶解度曲线可知,t2℃时,三种物质的溶解度的大小关系是Y>X=Z,故填Y>X=Z;
(3)由溶解度曲线可知,t3℃时160gX的饱和溶液中含有溶质质量为60g,溶剂质量为100g,降温到t1℃,溶液为t1℃的饱和溶液,溶剂质量不变,溶质质量为25g,所得溶液质量为125g,故填125;
(4)根据溶解度曲线可知,XY的溶解度都是随温度升高而增大,而Z的溶解度随温度升高反而减小,t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,没有析出晶体的是Z,故填Z。

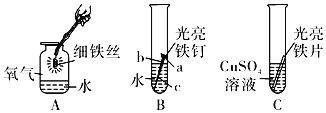
【题目】小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂,向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
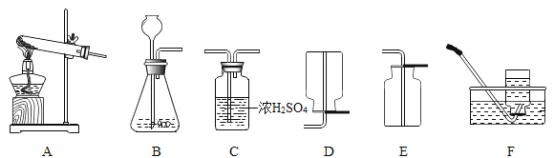
①写出用H2O2溶液制备O2的化学方程式:______。
②己知,浓硫酸常用于干燥气体。用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为______→______→______(填标号)。
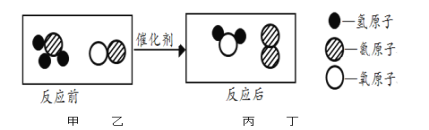
(2)FeCl3溶液做催化剂,向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。
(已知)FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl-
(问题)哪种微粒对H2O2溶液的分解起催化作用?
(假设)假设一:可能是H2O 假设二:可能是Fe3+ 假设三:可能是Cl-
(分析)①假设一不可能成立,理由是______。
(实验)
操作 | 现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 | 立即产生大量气泡 |
(结论)②假设______成立,而假设和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析,______(填化学式)更适合做该反应的催化剂。
【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%﹣5%的醋酸( CH3COOH)和水之外不含或极少含其他成分醋酸在水溶液中能电离出醋酸根离子(CH3COO﹣)和H+,请回答相应问题:
(1)白酯是______(填“纯净物”或“混合物”)。
(2)酿醋原理是在醋酸菌作用下乙醇(C2H5OH)与氧气反应,除生成醋酸外,还生成一种日常生活中最常见的物质,请写出该反应的化学方程式:______。
(3)某同学对白醋的性质进行如下探究:
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | ______ | 白醋能与活泼金属反应 |
③向滴有酚酞试液的氢氧化钠溶液中滴加白醋至过量 | ______ | 白醋能与碱发生中和反应,反应的化学方程式为 ______。 |
④将白醋滴加到碳酸钙表面 | ______ | 白醋能与某些盐反应 |