题目内容
实验是学习化学的重要手段,通过实验可以培养实践能力和创新精神
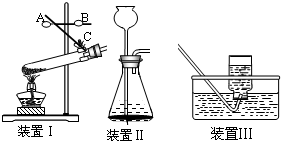
(一)实验室制取气体是初中重要的一组实验,结合下列实验装置图回答有关问题:
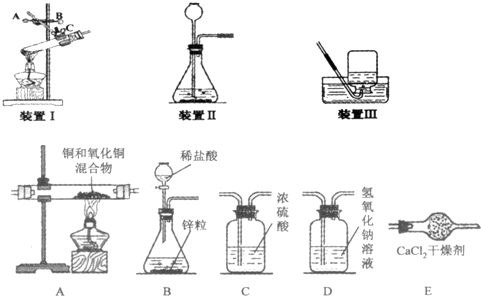
(1)装置 I是加热固体的装置,指出其中的错误
(2)使用装置Ⅱ前要检验气密性,方法是
(3)实验室制取H2、O2、CO、CO2等四种气体,可选用装置Ⅲ来收集的气体有
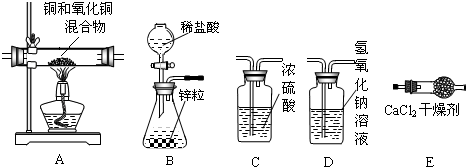
(二)某实验小组为测定铜和氧化铜混合物中氧化铜的质量分数,设计了用干燥纯净的氢气还原氧化铜的实验,所需实验装置如图所示,回答下列问题:
(4)将上图连接成整套装置,连接顺序依次为B→
(5)某同学用E装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会
(6)A装置中实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,则混合物中氧化铜的质量分数为多少.
(一)实验室制取气体是初中重要的一组实验,结合下列实验装置图回答有关问题:

(1)装置 I是加热固体的装置,指出其中的错误
试管口向上倾斜(或试管口没有略向下倾斜)
试管口向上倾斜(或试管口没有略向下倾斜)
,要改正错误需要操作的旋钮是AB
AB
(填字母).(2)使用装置Ⅱ前要检验气密性,方法是
用止水夹夹紧橡胶管,向长颈漏斗中加适量水,长颈漏斗中的水面保持不下降,说明装置不漏气
用止水夹夹紧橡胶管,向长颈漏斗中加适量水,长颈漏斗中的水面保持不下降,说明装置不漏气
.(3)实验室制取H2、O2、CO、CO2等四种气体,可选用装置Ⅲ来收集的气体有
H2、O2、CO
H2、O2、CO
(填化学式).(二)某实验小组为测定铜和氧化铜混合物中氧化铜的质量分数,设计了用干燥纯净的氢气还原氧化铜的实验,所需实验装置如图所示,回答下列问题:
(4)将上图连接成整套装置,连接顺序依次为B→
D
D
→C
C
→A
A
→E(填写字母).(5)某同学用E装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会
偏大
偏大
(填“偏大”、“偏小”或“不变”)(6)A装置中实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,则混合物中氧化铜的质量分数为多少.
分析:(1)根据该装置的使用注意事项分析:若试管口向上,水会沿着试管壁倒流引起试管的炸裂;通过调节铁架台来调整试管的高度和试管口的位置;
(2)使用装置Ⅱ前要检验气密性,方法是:用止水夹夹紧橡胶管,向长颈漏斗中加适量水,看长颈漏斗中的水面是否下降;
(3)排水法适合难溶于水的气体的收集;
(4)按照要求需要制取、除杂、干燥、还原、吸收的步骤分析;
(5)根据氯化钙增重的原因分析误差;
(6)根据反应前后固体减少的质量就是参加反应的氧化铜中氧元素的质量计算出氧化铜的质量,从而再计算氧化铜的质量分数.
(2)使用装置Ⅱ前要检验气密性,方法是:用止水夹夹紧橡胶管,向长颈漏斗中加适量水,看长颈漏斗中的水面是否下降;
(3)排水法适合难溶于水的气体的收集;
(4)按照要求需要制取、除杂、干燥、还原、吸收的步骤分析;
(5)根据氯化钙增重的原因分析误差;
(6)根据反应前后固体减少的质量就是参加反应的氧化铜中氧元素的质量计算出氧化铜的质量,从而再计算氧化铜的质量分数.
解答:解:(1)为防止水沿着试管壁倒流引起试管的炸裂,试管口应该略向下倾斜,所以该装置的错误是:试管口向上倾斜(或试管口没有略向下倾斜);因此可以通过调节B调节试管的高度,调节A调整试管口略向下倾斜;
(2)使用装置Ⅱ前要检验气密性,方法是:用止水夹夹紧橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水面保持不下降,说明装置不漏气;
(3)排水法适合难溶于水的气体的收集,H2、O2、CO、CO2等四种气体中只有二氧化碳易溶于水,故可选用装置Ⅲ来收集的气体有:H2、O2、CO;
(4)要用干燥纯净的氢气还原氧化铜,要求制取的气体显除杂(氢氧化钠溶液学生氯化氢)再干燥(浓硫酸吸水),然后通过氧化铜装置发生还原反应,用氯化钙吸水产物水,故连接装置的顺序为:B→D→C→A→E;
(5)氯化钙吸收的水分来自反应的产生的水和空气中的水,因此结果会偏大;
(6)实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,减少了0.4g就是氧化铜中氧元素的质量,故氧化铜的质量为:0.4g/(
×100%)=2g,
故氧化铜的质量分数为:
×100%=80%.
故答案为:(1)试管口向上倾斜(或试管口没有略向下倾斜);A B,只填A给(1分),只填B不给分);
(2)用止水夹夹紧橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水面保持不下降,说明装置不漏气;
(3)H2、O2、CO; (4)D→C→A (5)偏大 (6)80%.
(2)使用装置Ⅱ前要检验气密性,方法是:用止水夹夹紧橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水面保持不下降,说明装置不漏气;
(3)排水法适合难溶于水的气体的收集,H2、O2、CO、CO2等四种气体中只有二氧化碳易溶于水,故可选用装置Ⅲ来收集的气体有:H2、O2、CO;
(4)要用干燥纯净的氢气还原氧化铜,要求制取的气体显除杂(氢氧化钠溶液学生氯化氢)再干燥(浓硫酸吸水),然后通过氧化铜装置发生还原反应,用氯化钙吸水产物水,故连接装置的顺序为:B→D→C→A→E;
(5)氯化钙吸收的水分来自反应的产生的水和空气中的水,因此结果会偏大;
(6)实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,减少了0.4g就是氧化铜中氧元素的质量,故氧化铜的质量为:0.4g/(
| 16 |
| 80 |
故氧化铜的质量分数为:
| 2g |
| 2.5g |
故答案为:(1)试管口向上倾斜(或试管口没有略向下倾斜);A B,只填A给(1分),只填B不给分);
(2)用止水夹夹紧橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水面保持不下降,说明装置不漏气;
(3)H2、O2、CO; (4)D→C→A (5)偏大 (6)80%.
点评:本题考查了气体制取装置的气密性检验、收集、除杂、干燥及相关的计算,可依据题干的信息结合已有的化学知识完成.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目