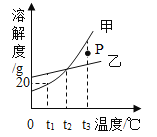
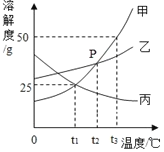
题目内容
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
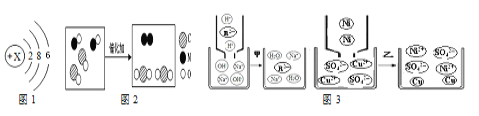
(1)图1中X=_______,该原子在反应中易_______(填“得”或“失”)电子形成_______(填“阴”或“阳”)离子。
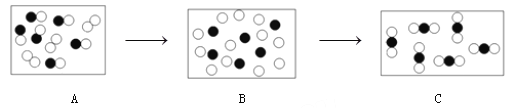
(2)写出图2所示的化学方程式___________________,该反应中CO表现___________(填“氧化”或“还原”)性。
(3)图3中反应甲的化学方程式为_________________,反应过程中溶液pH逐渐变_____(填“大”或“小”)。
(4)图3反应乙中,实际与Ni反应的粒子是_____;由反应可知金属活动性:Ni___Cu(填“﹥”或“﹤”)。
【答案】 16 得 阴 2CO+2NO![]() N2+2CO2 还原 H2R+2NaOH=Na2R+2H2O 小 Cu2+ >
N2+2CO2 还原 H2R+2NaOH=Na2R+2H2O 小 Cu2+ >
【解析】(1)在原子中,核内质子数=核外电子数,图1中X=2+8+6=16,最外层电子数为6,大于4个,在反应中易得到电子形成阴离子;(2)由微观示意图可知:该反应是一氧化碳和一氧化氮在催化作用下生成氮气和二氧化碳,化学方程式:2CO+2NO![]() N2+2CO2;该反应中CO表现还原性;(3)由图示可知:往氢氧化钠溶液中加入H2R,图3中反应甲的化学方程式为:H2R+2NaOH=Na2R+2H2O,反应过程中碱性减弱,溶液pH逐渐变小;(4)根据上图原理分析类推,Ni与硫酸铜反应生成铜和硫酸镍,该反应中实际参加反应的粒子是Ni和铜离子,铜被置换出来,由反应可知金属的活动性:Ni>Cu。
N2+2CO2;该反应中CO表现还原性;(3)由图示可知:往氢氧化钠溶液中加入H2R,图3中反应甲的化学方程式为:H2R+2NaOH=Na2R+2H2O,反应过程中碱性减弱,溶液pH逐渐变小;(4)根据上图原理分析类推,Ni与硫酸铜反应生成铜和硫酸镍,该反应中实际参加反应的粒子是Ni和铜离子,铜被置换出来,由反应可知金属的活动性:Ni>Cu。

练习册系列答案
相关题目