题目内容
【题目】请分别选用“>”、“<”或“=”填空:
(1)等质量的金属含原子个数:Mg_____Al;
(2)锰元素的化合价:K2MnO4_____KMnO4;
(3)铁元素的质量分数:Fe2O3_____Fe3O4;
(4)若用KClO3和MnO2混合加热至不再产生O2为止,其中MnO2在反应前后固体混合物中的质量:反应前_____反应后。
【答案】>;<;<;=;
【解析】
(1)镁的相对原子质量小于铝的相对原子质量,所以等质量的金属含原子个数:铝小于镁;
(2)锰酸钾中锰元素的化合价为+6价;高锰酸钾中锰元素的化合价为+7价;
(3)Fe3O4中,铁元素的质量分数为:![]() ×100%≈72.4%;Fe2O3中,铁元素的质量分数为:
×100%≈72.4%;Fe2O3中,铁元素的质量分数为:![]() ×100%=70%;
×100%=70%;
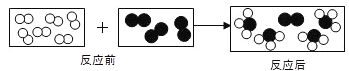
(4)二氧化锰在该反应中是催化剂,其质量在反应前后保持不变。

 名校课堂系列答案
名校课堂系列答案【题目】小李同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操作 | 装置 | 现象 |
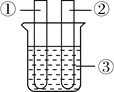
(1)取一个铜丝网,卷成筒形,固定在铁丝上. |
| |
(2)分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
(3)把铜丝网(连同固定的铁丝)插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(1)仪器②中实验的目的是________。
(2)能否得出铜可以加快H2O2分解速率的结论________(填“是”或“否”)。
(3)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将实验后的铜丝网进行加热
D.将铁丝换成铜丝
E.将过氧化氢溶液加水稀释
(4)实验后确定铜可以加快H2O2分解的速率,请写出该反应的化学式表达式_______________。
【题目】小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:
项目 | 实验操作 | 实验现象 | 实验结论或总结 | |
结论 | 总结 | |||
实验一 | 取5 mL 5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是____________________________ | 二氧化锰是过氧化氢分解的催化剂 |
实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | ________________________________________________________ | |
实验三 | ____________________________________________________________ | ________________________ | 二氧化锰能加快过氧化氢的分解 | |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用:
__________________________________________________________________。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:__________________________________。称量前,要将天平调平衡,首先要把_______________,然后才调节平衡螺丝;称量粉末状固体时若药品量不足,此时一只手用药匙取药品移至天平左盘上方,另一只手应____________________,使少量药品落人盘中。
第二方面的实验是利用“实验三”反应后试管内的固体剩余物继续实验,其目的是:________________________________________。
(4)过氧化氢能被二氧化锰催化分解放出O2的符号表达式为:
_________________________________________________________。