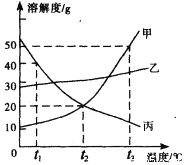
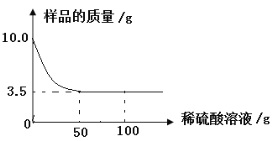
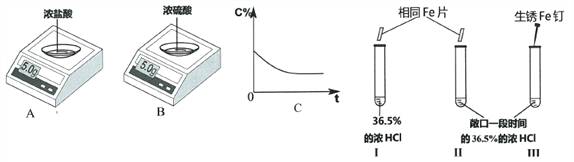
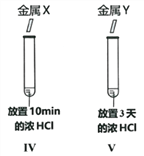
题目内容
【题目】某兴趣小组同学称取10g氧化铜和碳粉,通过下列实验对其中炭粉含量进行探究。实验前进行知识准备:2Cu + O2 ![]() 2CuO
2CuO
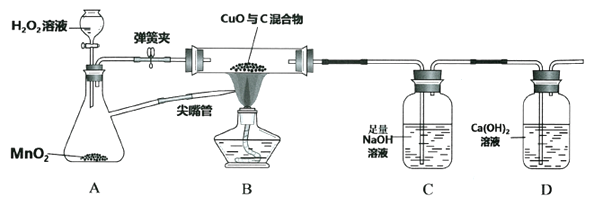
(1)关闭弹簧夹,打开分液漏斗活塞。写出A中的化学反应方程式________________________________。
(2)点燃酒精灯,将尖嘴管对着火焰,以提高温度,其原因是________________________________。玻璃管中发生的反应为 木炭还原氧化铜:C+ 2CuO → 2Cu + CO2↑,该反应条件是__________。
(3)反应一段时间,装置B中一定会观察到_____________________。装置D中澄清石灰水不变浑浊,说明__________________________________________。
(4)再打开弹簧夹,继续加热装置B,装置C中观察到的现象是____________________。
直至固体颜色不再变化后停止加热,称量装置C,质量比反应前增重4.4g,增重质量就是____________质量。通过计算可知装置B中含碳元素质量为____________g。本实验还可以通过称量____________________,也能计算出原混合物中碳的质量分数。
【答案】 2H2O2![]() O2↑+ 2H2O 氧气具有助燃性(或氧气使酒精燃烧更充分) 高温 黑色固体变成红色 CO2被NaOH完全吸收 有气泡冒出 生成的CO2 1.2 B中玻璃管及其中固体在反应前后的总质量
O2↑+ 2H2O 氧气具有助燃性(或氧气使酒精燃烧更充分) 高温 黑色固体变成红色 CO2被NaOH完全吸收 有气泡冒出 生成的CO2 1.2 B中玻璃管及其中固体在反应前后的总质量
【解析】(1)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,反应方程式为2H2O2![]() O2↑+ 2H2O
O2↑+ 2H2O
(2)尖嘴管中放出的是氧气,氧气具有助燃性(或氧气使酒精燃烧更充分),提供更高的温度;木炭还原氧化铜的条件是高温;
(3)反应一段时间,装置B中黑色固体变成红色;装置D中澄清石灰水不变浑浊,说明CO2被NaOH完全吸收;
(4)再打开弹簧夹,继续加热装置B,装置C中观察到的现象有气泡冒出;装置C中二氧化碳与氢氧化钠反应生成碳酸钠,使装置的质量增加,故装置C增加的质量就是生成二氧化碳的质量;4.4g的二氧化碳中碳元素的质量为![]() =1.2g;本实验还可以通过称量B中玻璃管及其中固体在反应前后的总质量,也能计算出原混合物中碳的质量分数。
=1.2g;本实验还可以通过称量B中玻璃管及其中固体在反应前后的总质量,也能计算出原混合物中碳的质量分数。

【题目】为测定某铜锌合金中锌的含量,取50g样品进行实验,将l00g稀盐酸分五次加入该样品中(杂质不溶于水也不参与反应,反应原理为:Zn+2HCl=ZnCl2+H2↑),充分反应后测得生成气体的总质量如表所示:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
试求:(1)m的数值为___________。
(2)该铜锌合金中锌的质量分数是___________?(写出计算过程)