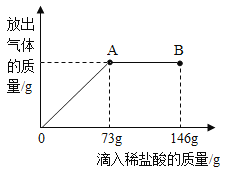
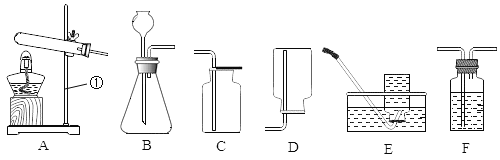
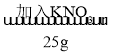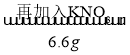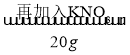题目内容
【题目】某实验小组的同学在用氢氧化钠溶液和稀盐酸做中和反应的实验时,滴加一些盐酸后没有看到现象,才想起来忘了加酚酞试液。于是赶忙补加几滴酚酞试液,发现溶液是无色的。他认为酸碱发生了中和反应,溶液已是中性的了。小亮同学对此提出了质疑,认为溶液也可能是酸性的。理由是______。
那么该小组同学实验得到的溶液究竟是中性的还是酸性的呢?
(1)写出该中和反应的化学方程式______。
(2)小亮的实验是:取少量溶液,滴加几滴石蕊试液,溶液变成___色,表明溶液呈酸性。
(3)小华的实验是:取少量溶液,滴到碳酸钠溶液中,看到_____,表明溶液呈酸性。反应的化学方程式为___。
[反思与拓展]除了上述方法,你还可用哪几类方法证明该溶液呈酸性(简要写出实验步骤、现象及结论)
方案一:_______。
方案二:_____。
【答案】酚酞在酸性溶液中也是无色的 ![]() 红 有气泡产生
红 有气泡产生 ![]() 取少量溶液滴到pH试纸上,对照比色卡,pH<7,该溶液呈酸性 取适量溶液,放入一根生锈的铁钉,铁锈消失,溶液变黄,该溶液呈酸性/取适量溶液,加入几粒锌粒,有气泡产生,该溶液呈酸性
取少量溶液滴到pH试纸上,对照比色卡,pH<7,该溶液呈酸性 取适量溶液,放入一根生锈的铁钉,铁锈消失,溶液变黄,该溶液呈酸性/取适量溶液,加入几粒锌粒,有气泡产生,该溶液呈酸性
【解析】
酚酞在酸性和中性的溶液中都显现无色,故答案为:酚酞在酸性溶液中也是无色的;
(1)氢氧化钠与盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)紫色石蕊遇酸显红色,检验的溶液显酸性;
(3)酸会与碳酸钠反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
[反思与拓展]
酸显酸性;酸会和金属反应生成氢气,也会溶解金属氧化物等性质,方案如下:
方案一:取少量溶液滴到pH试纸上,对照比色卡,pH<7,该溶液呈酸性;
方案二:取适量溶液,放入一根生锈的铁钉,铁锈消失,溶液变黄,该溶液呈酸性或取适量溶液,加入几粒锌粒,有气泡产生,该溶液呈酸性。

【题目】每年因金属腐蚀造成的经济损失远超所有自然灾害造成的损失总和。给金属“穿防 护服”是一种常见的防腐手段。
Ⅰ.铁质零部件表面发蓝
工业上常将铁质零件进行发蓝处理,使其表面形成一层致密的蓝黑色氧化膜。过程如下:
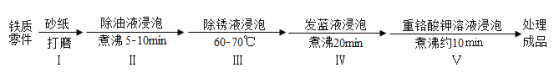
(1)步骤Ⅰ“砂纸打磨”过程发生的是_____(填“物理变化”或“化学变化”)。
(2)步骤Ⅱ~Ⅴ都在加热条件下进行,加热的作用是___;步骤Ⅲ处理时,用除锈液 (稀硫酸)浸泡时间不宜太长,原因是_____(用化学方程式表示)。
(3)为检验步骤Ⅳ处理后的质量是否合格,常往成品表面滴上 5%的硫酸铜溶液,若表面未形成致密的氧化膜,一段时间后将观察到的现象为______。
Ⅱ.铜质数据线表面镀锡
(4)选用铜作导线的主要原因是______,然而铜生锈将增加电阻,缩短使用寿命;锡在空气中表面会形成致密的二氧化锡(SnO2),二氧化锡能与盐酸发生反应,反应的化学方程式为_______。
(5)金属锡和铝的部分信息。
价格 | 熔点 | 氧化物熔点 | |
锡 | 133000 元/吨 | 232℃ | 1127℃ |
铝 | 12770 元/吨 | 660℃ | 2054℃ |
由表中信息可知,锡的价格远高于铝,选择在铜表面镀锡而非铝,主要因为锡的熔点更低,对于数据线的生产来说,熔点低的优势在于_______。
(6)剪取某废旧数据线,准确称取一定量样品放入足量盐酸中浸泡,观察到____,溶液仍为无色。完全反应后将剩余固体取出,洗净、____、称量。三次实验结果记录如下,导线中金属铜的质量分数为_________(计算结果保留到百分号内小数点后一 位)。
实 验 | 1 | 2 | 3 |
样品质量/g | 0.5529 | 0.5659 | 0.5860 |
剩余固体质量/g | 0.5291 | 0.5419 | 0.5604 |